Elektrokemija
Elektrokemija je veja kemije, ki se ukvarja z raziskovanjem kemijskih reakcij, ki potekajo v raztopinah na fazni meji med elektronskim prevodnikom (kovina ali polprevodnik) in ionskim prevodnikom (elektrolit). Pri elektrokemijskih reakcijah pride do prenosa elektronov med elektrodo in elektrolitom oziroma ionsko zvrstjo v raztopini.
Elektrokemijska reakcija je lahko spontana, njen potek pa je mogoče usmerjati tudi s pomočjo zunanje električne napetosti. V prvem primeru imamo opravka z galvanskim členom, v drugem pa z elektrolitsko celico.
Zgodovina
[uredi | uredi kodo]16. do 18. stoletje
[uredi | uredi kodo]
Električni pojavi so na Zemlji prisotni od samega začetka, vendar jih je človek začel bolje razumevati šele v 16. stoletju. Angleški znanstvenik William Gilbert je v tem stoletju kar 17 let posvetil eksperimentom z magnetizmom in v manjši meri tudi z elektriko, zaradi česar je postal znan kot Oče magnetizma. Odkril je več metod, s katerimi je izdeloval in izboljševal magnete.
Leta 1663 je nemški fizik Otto von Guericke izdelal prvi električni generator, ki je proizvajal statično elektriko s pomočjo trenja. Glavni sestavni del generatorja je bila velika žveplova krogla, ulita v votlo stekleno kroglo in pritrjena na vrtljivo os. Krogla se je med vrtenjem drgnila ob krpo in se medtem nabila s statično elektriko, ki so jo kasneje uporabili kot vir elektrike pri eksperimentih.
Sredi 18. stoletja je francoski kemik François de Cisternay du Fay odkril dva tipa statične elektrike, poleg tega je odkril tudi, da se isti naboji med seboj odbijajo in nasprotni naboji med seboj privlačijo. Du Fay je menil, da je elektrika sestavljena iz dveh fluidov: steklastega (pozitivnega) in smolnatega (negativnega). Pozitivni naboj dejansko dobimo, ko s pomočjo krpe nabijemo stekleno palico, negativnega pa, če namesto stekla uporabimo jantar. Du Fayeva ideja je predstavljala difluidno teorijo elektrike, ki jo je čez nekaj let Benjamin Franklin ovrgel s svojo monofluidno teorijo elektrike. Poskusi z električnim nabojem so privedli do novih odkritij; leta 1781 je Charles-Augustin de Coulomb razvil zakon o elektrostatskih privlakih.
V poznem 18. stoletju je italijanski fiziolog, anatom in fizik Luigi Galvani postavil temeljni kamen elektrokemije s svojim znamenitim poskusom z žabjimi kraki. Povezavo med kemijsko reakcijo in elektriko je opisal v delu "De Viribus Electricitatis in Motu Musculari Commentarius" (slovensko: O vplivu elektrike na gibanje mišic). V delu je Galvani predpostavil, da živalsko tkivo vsebuje (do tedaj prezrto) vitalno silo, ki aktivira živce in mišice, in jo poimenoval "živalska elektrika". Verjel je, da je nova sila oblika elektrike in jo postavil ob bok "naravni elektriki", ki jo povzročajo bliski in "umetni elektriki", ki jo je mogoče ustvariti s trenjem ustreznih teles.
19. stoletje
[uredi | uredi kodo]Galvanijevi znanstveni kolegi so njegovo teorijo v splošnem sprejeli, vendar se je kmalu izkazala za pomanjkljivo. Leta 1800 je Luigi Galvani, kot rezultat nestrinjanja z idejo o živalski elektriki izumil voltni steber, predhodnika električne baterije, ki je proizvajal stabilen električni tok. Volta je ugotovil, da dobi najboljšo baterijo, ko je kot par različnih kovin uporabil cink in srebro. Na začetku je izvajal eksperimente s posameznimi celicami, ki jih je povezal zaporedno. Celico je sestavil iz vinske čaše, ki jo je napolnil s slanico v katero je potopil elektrodi iz dveh različnih kovin. V voltnem oziroma galvanskem stebru je vinske čaše zamenjal s kartonskimi, ki jih je prej namočil v slanico (število celic, ki jih je lahko uporabil in posledično napetost, ki jo je proizvajal steber, je omejeval pritisk, ki je v spodnjem delu stebra iz kartonskih čašic iztisnil slanico).
Prav tako je leta 1800 Williamu Nicholsonu in Johannu Wilhelm Ritterju s pomočjo elektrolize razgraditi vodo na kisik in vodik. Kmalu za tem je Ritter odkril še proces galvanizacije. Pri svojem delu je opazil, da sta količina kovine in količina kisika, ki se pri elektroliznem postopku izločita odvisna od razdalje med elektrodama. V 1801. je Ritter prvič opazil termoelektrične tokove in sodeloval pri Thomas Johann Seebeckovemu odkritju termoelektrike.
V prvem desetletju 19. stoletja je William Hyde Wollatson izboljšal galvanski steber, Sir Humpry Davy pa je na podlagi svojih eksperimentov z elektrolizo prišel do zaključka, da električno napetost v preprostih elektrolitskih celicah generira kemijska reakcija, ki se vzpostavi med dvema substancama z nasprotnim nabojem. Njegovo delo je vodilo k odkritju natrija, kalija in kmalu tudi zemljo alkalijskih kovin v letu 1808.
Hans Christian Ørsted je leta 1820 odkril magnetni efekt, ki ga proizvajajo električni tokovi in postavil nov mejnik v razvoju znanosti, nadaljnje delo na področju elektromagnetizma pa prepustil drugim. André-Marie Ampère je Ørstedov eksperiment kmalu ponovil in ga formuliral še matematično.
Leta 1821 je estonsko-nemški fizik Thomas Johann Seebeck pokazal, da se med dvema kovinama vzpostavi električna napetost, če sta spoja med kovinama na različnih temperaturah in odkril termočlen.
Leta 1827 je Georg Ohm v knjigi "Die galvanische Kette, mathematisch bearbeitet" (sl. Matematično obravnavani galvanski krogi), v kateri je obravnaval celotno teorijo elektrike, izpeljal sloviti zakon.
Michael Faraday je na osnovi eksperimentov leta 1832 objavil dva zakona elektrokemije. Leta 1836 je John Daniell izumil primarno celico, pri kateri se med proizvodnjo elektrike izločal vodik. Rešil je tudi problem polarizacije in ugotovil, da amalgamacija cinka z živim srebrom v baterijah proizvede boljšo napetost.
Prve gorivne celice je leta 1839 izumil William Grove, leta 1846 je Wilhelm Weber razvil elektrodinamometer, leta 1866 pa je Georges Leclanché patentiral novo celico na osnovi cinka in ogljika, ki je postala predhodnica prvi splošno uporabljani bateriji.
Leta 1884 je Svante August Arrhenius objavil tezo o "Recherches sur la conductibilité galvanique des électrolytes" (sl. Raziskave o galvanski prevodnosti elektrolitov). Iz dobljenih rezultatov je avtor sklepal, da v vodi raztopleni elektroliti do dolčene mere razpadejo (disocirajo) v nasprotno nabite pozitivne (katione) in negativne ione (anione). Leta 1886 je delo nadgradil Friedrich Ostwald in povezal električno prevodnost z elektrolitsko disociacijo organskih kislin.
Paul Héroult in Charles M. Hall sta leta 1886 po principih, ki jih je opisal Faraday, razvila uspešno metodo za pridobivanje aluminija.
Leta 1888 je Walther Hermann Nernst objavil teorijo o elektromotivni sili galvanskih členov, leto kasneje pa je pokazal, kako lahko tokovno-napetostne karakteristike galvanskih členov lahko uporabimo za izračun spremembe proste energije in teorijo povezal z matematično enačbo. Nernstova enačba opisuje razmerje med napetostjo in sestavo galvanskega člena.
Leta 1898 je Fritz Haber ugotovil, da pri elektrolitskih procesih s konstantno napetostjo katode dobimo dobro definirane produkte redukcije. Istega leta je razložil postopno redukcijo nitrobenzena na katodi, reakcija pa je postala model za druge podbne reakcije.
20. stoletje
[uredi | uredi kodo]Po letu 1900 se je razvoj elektrokemije močno pospešil. Pomembnejši dogodki na področju elektrokemije v 20. stoletju:
- 1902 - Ustanovijo Elektrokemijsko skupnost (The Electrochemical Society, ECS).
- 1909 - Robert Andrews Millikan izvede vrsto eksperimentov, s katerimi je hotel določiti naboj enega elektrona.
- 1923 - Johannes Nicolaus Brønsted in Thomas Martin Lowry hkrati objavita enako teorijo o obnašanju kislin in baz, ki je nastala na elektrokemijski podlagi.
- 1937 - Arne Tiselius je sestavil prvo aparaturo za elektroforezo in leta 1948 prejel Nobelovo nagrado za njegovo delo o elektroforezi beljakovin.
- 1949 - Ustanovijo Mednarodno elektrokemijsko skupnost (International Society of Electrochemistry, ISE).
- V 60. in 70. letih Revaz Dogonadze in njegovi učenci razvijejo kvantno elektrokemijo.
Temelji elektrokemije
[uredi | uredi kodo]Redoks reakcije
[uredi | uredi kodo]Elektrokemijski procesi vključujejo redoks reakcije, pri katerih pride do prenosa elektrona iz/na molekulo ali ion. Zvrsti, ki sodeluje pri redoks reakciji se pri tem spremeni oksidacijsko stanje. Reakcija lahko poteče pod vplivom zunanje električne napetosti, ali pa tako da se sprosti kemijska energija.
Oksidacija in redukcija
[uredi | uredi kodo]Atome, ione in molekule, ki sodelujejo v elektrokemijski reakciji lahko okarakteriziramo glede na razliko med številom elektronov in številom protonov. Razlika predstavlja oksidacijsko stanje zvrsti, ki je lahko pozitivno (označimo s +) ali pa negativno (označimo z -). Na primer, kloridni ion Cl- ima oksidacijsko stanje -1. Atomu ali ionu, ki elektron odda drugemu atou ali ionu, se oksidacijsko stanje poveča, sprejemniku negativno nabitega elektrona pa se oksidacijsko stanje zmanjša. Oksidacija in redukcija vedno potekata v medsebojni soodvisnoti; ena zvrst se oksidira, medtem ko se druga reducira. Pojav zaradi tega imenujemo redoks reakcija.
Pri reakciji med elementarnim natrijem in elementarnim klorom natrijev atom odda elektron in prevzame oksidacijsko število +1, klorov atom pa elektron sprejme, pri čemer se mu oksidacijsko število zmanjša na -1. Predznak oksidacijskega stanja (pozitivno ali negativno) predstavlja dejanski naboj posameznega iona. Zaradi privlaka nasprotno nabitih natrijevih in kloridnih ionov se med njima vzpostavi ionska vez
Izgubo oziroma oddajanje elektronov iz atoma ali molekule imenujemo oksidacija, sprejemanje elektronov pa redukcija. V kovalentni vezi, kjer se elektroni razdelijo med dva ali več atomov z večjo razliko v elektronegativnosti, se pri določanju oksidacijskega stanja elektron dodeli atomu z največjo elektronegativnostjo. Najbolj elektonegativni atomi imajo potemtakem najnižje oksidacijsko število.
Atom ali molekula, ki pri redoks reakciji izgubi elektrone, se imenuje reducent, zvrst, ki jih sprejme, pa oksidant. Reducenti se pri redoks reakcijah vedno oksidirajo, oksidanti pa reducirajo. Najbolj reprezentativen oksidant je kisik, po katerem je oksidacija tudi dobia ime (iz grškega korena starogrško ὀξύς: oxys), vendar ni edini. Kljub imenu pri oksidaciji ni nujna prisotnost kisika. Plamen lahko gori tudi v prisotnosti drugega oksidanta, na primer floura. Plameni, kjer kot oksidant uporabimo fluor, gorijo bolj intenzivno, ker je fluor močnejši oksidant (ima večjo elektronegativnost) kot kisik.
Vezava kisika na atom ali molekulo privede do oksidacije zvrsti (medtem ko se kisik reducira). Na primer, pri oksidaciji oktana s kisikom, pri kateri nastaneta ogljikov dioksid in voda, imata na začetku tako kisik kot ogljik oksidacijsko stanje 0. Pri nastanku CO2 ogljik izgubi štiri elektrone in postane C4+, vsak kisikov atom pa dobi dva elektrona in postane O2-. V organskih spojinah, kot sta na primer propan ali metanol, izguba atoma vodika predstavlja oksidacijo molekule. Ko vodikov atom izstopi iz molekule, s seboj vzame elektron, ki se porabi za nastanek druge kovalentne vezi z nekovino. Nasprotno pa pri odstranjevanju kisikovega atoma ali dodajanju vodikovega atoma na molekulo poteče redukcija.
Urejanje redoks reakcij
[uredi | uredi kodo]Elektrokemijske reakcije v vodnih medijih so lažje razumljive, če jih urejamo s pomočjo ionsko-elektronske metode. K posameznim reakcijam elektrokemijskega polčlena dodamo elektrone, H+, OH- in H2O, s katerimi kompenziramo spremembe oksidacijskega stanja.
Kislo okolje
[uredi | uredi kodo]V kislem okolju H+ ion in H2O pomagata uravnotežiti celotno reakcijo. Primer: Mangan reagira z natrijevim bizmutatom.
Zaradi zakona o ohranitvi mase je število elektronov, ki se porabijo pri redukciji, enako številu elektronov, ki se sprostijo pri oksidaciji. Enačbo lahko enostavno uredimo, če enačbo polčlena, kjer poteka redukcija, pomnožimo s številom elektronov, ki se sprostijo pri oksidaciji, enačbo polčlena, na katerem poteka oksidacija, pa pomnožimo s številom elektronov, ki se porabijo pri redukciji, ter na koncu obe enašbi seštejemo.
Urejena reakcija:
Bazično okolje
[uredi | uredi kodo]V bazičnem okolju OH- ion in H2O pomagata uravnotežiti celotno reakcijo. Primer: Kalijev permanganat reagira z natrijevim sulfitom.
Postopek urejanja je enak kot v kislem mediju. Število elektronov, ki se pri oksidaciji sprostijo, mora biti enako številu elektronov, ki se pri redukciji porabijo.
Urejena reakcija:
Nevtralno okolje
[uredi | uredi kodo]Tudi v tem primeru uporabimo enako metodo urejanja kot v kislem in bazičnem okolju. Primer: Popolno zgorevanje propana
Število sproščenih elektronov mora biti enako številu porabljenih elektronov.
Urejena reakcija:
Elektrokemijski člen
[uredi | uredi kodo]Elektrokemijski člen je naprava, ki energijo, ki se sprosti pri spontani redoks reakciji, pretvarja v električni tok. Sem spada tudi galvanski oziroma voltaični člen (pomenovan po Luigiju Galvaniju oziroma Alessandru Volti).
Vsak elektrokemijski člen je sestavljen iz dveh prevodnih elektrod (katode in anode). Po definiciji je katoda tista elektroda, na kateri poteka redukcija, anoda pa tista elektroda na kateri poteka oksidacija. Elektrode so lahko narejene iz kateregakoli dovolj elektroprevodnega materiala, na primer iz kovine, polprevodnikov, grafita in celo prevodnih polimerov. Med elektrodama se nahaja elektrolit, v katerem se prosto gibljejo ioni.
V galvanskem členu se uporabljata elektrodi iz dveh različnih kovin. Vsaka elektroda se nahaja v elektrolitu, kjer pozitivno nabiti ioni predstavljajo oksidirano obliko materiala, iz katerega je narejena elektroda. Med elektrokemijsko reakcijo ena elektroda prevzame vlogo katode (na njej poteka redukcija), druga pa vlogo anode (na njej poteka oksidacija). V katodnem delu galvanskega člena kovinski kationi v raztopini sprejemajo elektrone, zaradi česar se jim oksidacijsko stanje zmanjša na 0, pri tem pa nastanejo kovinski atomi, ki se odložijo na elektrodo. Sočasno na anodi poteka oksidacija, pri čemer nastajajo kovinski kationi (oksidacijsko stanje postane večje od 0), elektroda pa se raztaplja. Elektrodi v galvanskem členu morata biti med seboj povezani z električnim krogom, da omogočimo tok elektronov z anode na katodo. Tok elektronov lahko spotoma opravlja še električno delo; poganja elektromotor ali ustvarja svetlobo v žarnici
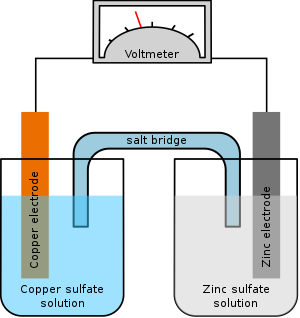
Splošno znan glavanski člen je na primer Danilleov člen. Galvanski člen je sestavljen iz bakrove in cinkove elektrode, ki sta potopljeni v raztopino bakrovega in cinkovega sulfata.
Posamezni polreakcji v členu sta:
Pri tem primeru vlogo anode prevzame cinkova elektroda; na njej poteka oksidacija (elektroda oddaja elektrone) cinkovih atomov do Zn2+ ionov. Bakrova elektroda prevzame vlogo katode; na njej poteka redukcija (elektroda sprejema elektrone) Cu2+ ionov do kovinskega bakra. Celica sestavlja enostavno baterijo, ki po električnem krogu spontano poganja tok elektronov iz anode na katodo. Potek kemijske reakcije lahko obrnemo v nasprotno smer, če na galvanski člen priključimo zunanjo napetost, pri čemer se na katodi začne nalagati cink, na anodi pa raztapljati baker.
Če hočemo v galvanskem členu vzpostaviti popoln električni krog, moramo poleg elektroprevodnosti zagotoviti tudi ionsko prevodnost med katodo in anodo. Najenostavnejši način je, da sta raztopini posameznih ionov neposredno v stiku preko porozne frite ali ionsko prevodne membrane, ki preprečuje medsebojno mešanje raztopin. Manjše mešanje elektrolitov dosežemo, če namesto frite ali membraneuporabimo elektrolitski ključ - cevko v obliki narobe obrnjene črke U, napolnjeno z nasičeno raztopino elektrolita v gelu. Kot elektrolit v elektrolitskem ključu se najpogosteje uporablja kalijev klorid (KCl). Med delovanjem galvanskega člena negativno nabiti ioni potujejo proti pozitivno nabiti elektrodi, pozitivno nabiti ioni pa proti negativno nabiti elektrodi.
V elektrokemiji se za poenostavljen opis galvanskega člena najpogosteje uporablja celični diagram. Za Daniellov člen ga zapišemo:
Na prvem mestu je reducirana oblika kovine, ki se v glavanskem členu oksidira na anodi (Zn) in je s pokončno črto, ki predstavlja fazno mejo med elektrodo in raztopino, ločena od oksidirane oblike kovine (Zn2+). Dvojna pokončna črta predstavlja elektrolitski ključ med celicama. Sledi oksidirana oblika kovine (Cu2+), ki se bo na katodi (s prehodom preko fazne meje; pokončna črta) reducirala do kovine (Cu). Koncentracija elektrolitov v galvanskem členu predstavlja pomemben parameter, saj je od nje odvisna končna napetost galvanskega člena.
Električno napetost, ki se vzpostavi v glavanskem členu lahko izmerimo z voltmetrom.
Standardni elektrodni potencial
[uredi | uredi kodo]Vsak elektrokemijski polčlen ima pri določeni temperaturi in koncentraciji elektrolita točno določen elektrodni potencial, zaradi česar je polčlene smiselno razvrstiti v vrsto standardnih elektrodnih potencialov. Ker potenciala ene same elektrode ne moremo izmeriti, kot drugo elektrodo v galvanskem členu uporabimo standardno vodikovo elektrodo (SHE), ki ima po dogovoru napetost enako 0,0 V. Na njej poteka nasledjna kemijska reakcija:
Reakcija je zapisana v smeri redukcije, vendar lahko SHE prevzame tako vlogo anode, kot tudi vlogo katode, glede na relativni oksidacijsko-redukcijski potencial drugega dela galvanskega člena. SHE za delovanje potrebuje plinasti vodik, ki ga pri tlaku 1 atmosfere prepihujemo preko platinaste elektrode, potopljene v raztopino elektrolita z aktivnostjo H+ 1 (večkrat privzamemo, da je [H+ = 1 mol/L).
Standardno vodikovo elektrodo preko elektrolitskega ključa povežemo z drugo elektrodo in ustvarimo galvanski člen. Če tudi pri drugi elektrodi vzdržujemo standardne pogoje, izmerjeno napetost galvanskega člena imenujemo standardni elektrodni potencial. Polariteta standardnega elektrodnega potenciala podaja informacijo o relativni vrednosti redukcijskega potenciala glede na SHE. Če je izmerjeni potencial večji od potenciala SHE, na drugi elektrodi poteka redukcija, SHE pa se obnaša kot anoda (Primer: standardni elektrodni potencial Cu|Cu2+ je 0,337 V), v nasprotnem primeru pa SHE deluje kot katoda, na drugi elektrodi pa poteka oksidacija (Primer: standardni elektrodni potencial Zn|Zn2+ je -0,763 V).
Standardni elektrodni potenciali so po navadi tabelirani kot redukcijski potenciali, vendar so elektrodne reakcije reverzibilne, zato je potek reakcije na posamezni elektrodi odvisen od oksidacijsko-redukcijskega potenciala obeh elektrod. Potencial (napetost) standardnega galvanskega člena lahko določimo, če poznamo standardne elektrodne potenciale za vsak galvanski polčlen posebej. Polčlen z nižjim potencialom bo prevzel vlogo anode - na njem bo potekala oksidacija. Napetost glavanskega člena nato izračunamo kot vsoto redukcijskega potenciala katode in oksidacijskega potenciala katode.
Stnadardni elektrodni potencial za bakrovo elektrodo:
Pri standardni temperaturi, tlaku in koncentaciji je napetost glavanskega člena enaka 0,34 V. Po definiciji je elektrodni potencial SHE enak 0,0 V, zato bakrova elektroda opravlja vlogo katode:
ali
Sprememba stehiometričnih koeficientov v urejeni reakciji ne vpliva na potencial bakrove elektrode, ker so standardni elektrodni potenciali intenzivne količine.
Termodinamika redoks reakcij
[uredi | uredi kodo]Med delovanjem galvanskega člena se kemijska energija spreminja v električno energijo. Električno energijo lahko matematično izrazimo kot produkt med napetostjo galvanskega člena in električnega naboja, ki se prenese preko zunanjega električnega kroga.
pri čemer je potencial galvanskega člena v voltih (V) in naboj v coulombih, ki se prenese v določenem časovnem intervalu. lahko zapišemo kot produkt med številom prenesenih elektronov (v molih) in Faradayeve konstante. Največjo napetost galvanskega člena lahko izmerimo, ko čez galvanski člen ne teče električni tok in jo uporabimo pri izračunu največje možne energije, ki se sprosti pri kemijski reakciji. Električno delo, ki ga člen opravi je odvisno od energije člena, med njima pa velja naslednja zveza:
kjer je delo, ki ga sistem sprejme definirano kot pozitivno. Prosto energijo, ki jo odda sistem lahko zapišemo kot:
Pozitivni potencial galvanskega člena nam da negativno spremembo Gibbsove proste energije, kar je v skladu s smerjo električnega toka, ki teče v zunanjem električnem krogu iz katode do anode. Če proces obrnemo s pomočjo zunanje električne napetosti, moramo medtem ko v galvanskem členu poteka elektroliza sistemu dovajati delo.
Pri spontanih kemijskih reakcijah (kjer je sprememba Gibbsove proste energije manjša od nič) lahko z galvanskimi členi generiramo električni tok. Na tej osnovi delujejo vse baterije in gorivne celice. Na primer, v gorivni celici lahko poteka reakcija, pri kateri se kisik (O2) in vodi (H2) spajata v vodo, pri tem pa se sproščata električna in toplotna energija.
Nespontano elektrokemijsko reakcijo pa lahko prisilimo, da teče v želeni smeri, tako da preko člena spuustimo električni tok pri določeni napetosti. Tipičen primer je elektroliza vode, pri kateri se sproščata kisik in vodik.
Zvezo med ravnotežno konstanto K in spremembo Gibbsove proste energije lahko zapišemo:
Ko enačbo preuredimo pa dobimo zvezo med ravnotežno konstanto in napetostjo galvanskega člena:
Napetost galvanskega člena in spremembe koncentracije
[uredi | uredi kodo]Nernstova enačba
[uredi | uredi kodo]Standardni potencial elektrokemijskega člena dobimo samo, če vzdržujemo standardne pogoje za vse reakcije, ki v elektrokemijskem členu potekajo. Ko koncentracije reaktantov odstopajo od standardnih koncentracij, tudi potencial odstopa od standardnega električnega potenciala. V začetku 20. stoletja je Walther Hermann Nernst predstavil matematični model, ki je povezoval koncentracijo elektrolitov z napetostjo galvanskega člena. V poznem 19. stoletju je Josiah Willard Gibbs izpeljal teorijo, s katero je bilo mogoče glede na spremembo Gibbsove proste energije določiti ali je potek kemijske reakcije spontan ali ne:
Nernst je Gibbsovo teorijo dopolnil, tako da je vanjo vključil prispevek električnega potenciala nabitih delcev. Spremembo Gibbsove proste entalpije lahko povežemo z napetostjo galvanskega člena:
Ko enačbo preuredimo dobimo:
Pri standardnih pogojih ( in ob upoštevanju zveze med naravnim in desetiškim logaritmom dobimo:
Koncentracijska celica
[uredi | uredi kodo]Koncentracijska celica je elektrokemijska celica, v kateri sta obe elektrodi iz enakega materiala, elektrolit, v katerega sta elektrodi potopljeni, pa je sestavljen iz enakih ionov, vendar se koncentracija elektrolita razlikuje v posamezni celici galvanskega člena.
Primer: sestavimo elektrokemijsko celico, kjer sta dve bakrovi elektrodi potopljeni v raztopini bakrovega sulfata s koncentracijama 0,05 M in 2,00 M. Tak tip celice po proizvedel potencial, k iga lahko napovemo z Nernstovo enačbo. Na obeh elektrodah poteka enaka reakcija (vendar v obratni smeri na katodi).
Po Le Chatelierjevem principu sklepamo, da je reakcija bolj nagnjena k redukciji, če povečamo koncentracijo Cu2+ ionov. Redukcija v celici bo potemtakem potekala v tistem delu galvanskega člena, kje je koncentracija kovinskih ionov večja, oksidacija pa v tistem delu, kjer je koncentracija kovinskih ionov manjša.
Zapišemo lahko še celični diagram:
Reakciji za oksidacijo in redukcijo pa sta:
Napetost lahko izračunamo s pomočjo Nernstove enačbe:
Vrednost je za galvanski člen, kjer sta elektrodi iz enakega materiala enaka 0. Ko v Nernstovo enačbo vstavimo izbrane koncentracije lahko izračunamo potencial koncentracijskega člena.
Nernstova enačba je pomembna tudi za razumevanje električnih efektov v celicah in organelih. Električni procesi potekajo v sinapsah, pri bitju srca pa tudi v mirovnem stanju somatskih celic.
Uporaba elektrokemije
[uredi | uredi kodo]Tako v naravi kot v industriji potekajo različni elektrokemijski procesi. Elektrokemija se uporablja pri nanosu kovinskih in oksidnih plasti na različne materiale, pa tudi pri detekciji alkohola z alkotesti v izdihanem zraku preko redoks reakcije, v kateri nastopa etanol.[1] Nastanek kemijske energije preko fotosinteze je nedvomno eden izmed pomembnejših elektrokemijskih procesov, kot tudi proizvodnja kovin, kot sta aluminij in titan iz njihovih rud. Na osnovi redoks reakcije delujejo tudi nekatere aparature za določevanje krvnega sladkorja pri bolnikih z sladkorno boleznijo.
Električni tokovi živčnih impulzov v nevronih delujejo na osnovi prehajanja kalijevih in natrijevih ionov preko celičnih membran. Nekatere živali, kot so električni skati (Torpediniformes), lahko ustvarijo zelo visoko napetost (od 8 do 220 V, odvisno od vrste) v specializiranih celicah, imenovanih elektrociti, s katerimi v napadu onemogočijo mnogo večje živali, bodisi za namene prehranjevanja bodisi za obrambo.[2]
Glej tudi
[uredi | uredi kodo]Opombe in sklici
[uredi | uredi kodo]- ↑ "Electronic Alcohol Breath Analyzers". Craig Medical Distribution, Inc. Pridobljeno 04.06.2010.
- ↑ Martin, R.A. "Electric Rays". ReefQuest Centre for Shark Research. Pridobljeno 04.06.2010.
Viri
[uredi | uredi kodo]- Grdenić, D. (2007). Zgodovina Kemije. Ptujska Gora: In obs medicus. (COBISS)
- J. O' M. Bockriss, A. & Reddy, K.N. (1998). Modern Electrochemistry Vol. 1, Ionics, 2. izdaja. New York: Plenum Press. (COBISS)
- J. O' M. Bockriss, A. & Reddy, K.N. (2000). Modern Electrochemistry Vol. 2a, Fundamentals of electrodics, 2. izdaja. New York: Plenum Press. (COBISS)
- J. O' M. Bockriss, A. & Reddy, K.N. (2000). Modern Electrochemistry Vol. 2b, Electrodics in chemistry, engineering, biology, and environmental science, 2. izdaja. New York: Plenum Press. (COBISS)
- Kortum, G. (1948). Lehrbuch der Elektrochemie. Wiesbaden: Dietrich'Sche Verlagsbuchhandlung.