Ribose
| Ribose Alerta sobre risco à saúde[1] | |
|---|---|

| |
| Nome IUPAC | (3R,4S,5R)-5-(Hydroxymethyl)tetrahydrofuran-2,3,4-triol |
| Identificadores | |
| Número CAS | |
| PubChem | |
| SMILES |
|
| Propriedades | |
| Fórmula molecular | C5H10O5 |
| Massa molar | 150.13 |
| Aparência | White solid |
| Ponto de fusão |
99 °C, 372 K, 210 °F |
| Solubilidade em água | Very soluble |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
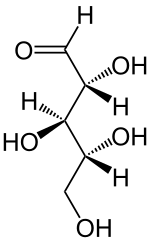
A ribose, também denominada D-Ribose, é um carboidrato monossacarídeo pentose da família das aldopentoses (função aldeído: CHO), constituída por cinco átomos de carbono, dez de hidrogênio e cinco de oxigênio (C5H10O5). Foi descoberta em 1905 por Phoebus Levene.
Faz parte da estrutura do RNA e de diversos nucleosídeos relacionados com o metabolismo: ATP (adenosina trifosfato), GTP (guanosina trifosfato), NADH (nicotinamida adenina dinucleotídeo), entre outros.
Funções
[editar | editar código-fonte]ATP é derivado da ribose; contém uma ribose, três grupos fosfato e uma base adenina. ATP é criado durante respiração celular do adenosina difosfato (ATP com um grupo fosfato a menos).
Biossíntese de nucleotídeos
[editar | editar código-fonte]Os nucleotídeos são sintetizados através de salvamento ou síntese de novo.[2] Salvamento de nucleotídeos usa pedaços de nucleotídeos produzidos anteriormente e os ressintetiza para uso futuro. Em de novo, aminoácidos, dióxido de carbono, derivados de folato e Fosforribosil pirofosfato (PRPP) são usados para sintetizar nucleotídeos.[2] Tanto a síntese de novo quanto a de salvamento requerem PRPP, que é sintetizado a partir de ATP e ribose 5-fosfato por uma enzima chamada PRPP sintetase.[2]
Vias de sinalização
[editar | editar código-fonte]Ribose é um bloco de construção em moléculas de sinalização secundária, tais como monofosfato cíclico de adenosina (cAMP) o qual é derivado do ATP. Um caso específico no qual cAMP é usado é em via de sinalização dependente de cAMP. Em via de sinalização de cAMP, um receptor hormonal estimulador ou inibitório é ativado por uma molécula sinal. Esses receptores estão ligados a um mecanismo regulador estimulador ou inibitório de proteína G. Quando uma proteína G estimulante é ativada, adenilato ciclase catalisa ATP em cAMP pelo uso de Mg2+ ou Mn2+. cAMP, um mensageiro secundário, então passa a ativar proteína quinase A, a qual é uma enzima que regula o metabolismo celular. Proteína quinase A regula enzimas metabólicas por fosforilação a qual causa uma alteração na célula dependendo da molécula sinalizadora original. O oposto ocorre quando uma proteína G inibitória é ativada; a proteína G inibe adenilil ciclase e ATP não é convertido a cAMP.

Metabolismo
[editar | editar código-fonte]A ribose é chamada de "moeda molecular" devido ao seu envolvimento nas transferências de energia intracelular.[3] Por exemplo, dinucleótido de nicotinamida e adenina (NAD), dinucleótido de flavina e adenina (FAD) e fosfato de dinucleótido de nicotinamida e adenina (NADP) todos contém o grupamento d-ribofuranose. Cada um deles pode ser a forma derivada d-ribose depois de ser convertido para d-ribose-5-fosfato pela enzima riboquinase.[4][5] NAD, FAD e NADP atuam como aceitadores de elétrons em reações redox bioquímicas nas principais vias metabólicas, incluindo glicólise, o ciclo do ácido cítrico, fermentação e a cadeia de transporte de elétrons.

Isomeria
[editar | editar código-fonte]D-Ribose possui a mesma configuração química que a molécula de D-gliceraldeído.

Em solução aquosa, a forma isomérica predominante é a beta-D-Ribopiranose (58,5%).[6]
| Isômeros da D-Ribose | ||
|---|---|---|
| Forma linear | Projeção de Haworth | |
 <1% |
 α-D-Ribofuranose 6,5% |
 β-D-Ribofuranose 13,5% |
 α-D-Ribopiranose 21,5% |
 β-D-Ribopiranose 58,5% | |
Modificações
[editar | editar código-fonte]Modificações na natureza
[editar | editar código-fonte]Riboquinase catalisa a conversão de d-ribose a d-ribose 5-fosfato. Uma vez convertido, d-ribose-5-fosfato está disponível para a produção dos aminoácidos triptofano e histidina, ou para o uso na via das pentoses-fosfato. A absorção de d-ribose é 88–100% no intestino delgado (até 200 mg/kg·h).[7]
Uma modificação importante ocorre na posição C2' da molécula de ribose. Ao adicionar um grupo O-alquil, a resistência nuclear do RNA é aumentada devido a forças estabilizadoras adicionais. Essas forças estão se estabilizando devido ao aumento de ligação de hidrogênio intramolecular e um aumento na estabilidade da ligação glicosídica.[8]
O aumento resultante da resistência leva ao aumento da meia-vida de siRNA e o potencial terapêutico potencial em células e animais.[9] A metilação de ribose em locais específicos está correlacionado com uma diminuição na estimulação imunológica.[10]
Modificações sintéticas
[editar | editar código-fonte]Junto com a fosforilação, as moléculas de ribofuranose podem trocar seu oxigênio com selênio e enxofre para produzir açúcares semelhantes que variam apenas na posição 4'. Esses derivados são mais lipofílicos do que a molécula original. O aumento da lipofilicidade torna essas espécies mais adequadas para uso em técnicas tais como RCP, aptâmero de RNA pós-modificação, tecnologia anti-sentido e por dados cristalográficos de raios X de fase.[9]
Semelhante às modificações 2' na natureza, uma modificação sintética da ribose inclui a adição de flúor na posição 2'. Esta ribose fluorada age de forma semelhante à ribose metilada porque é capaz de suprimir a estimulação imunológica dependendo da localização da ribose na fita de DNA.[8] A grande diferença entre metilação e fluoração é que a última ocorre somente por meio de modificações sintéticas. A adição de flúor leva a um aumento na estabilização da ligação glicosídica e a um aumento das ligações de hidrogênio intramoleculares.[8]
Usos médicos
[editar | editar código-fonte]d-Ribose tem sido sugerido para uso na gestão de insuficiência cardíaca congestiva[11] (bem como outras formas de doenças cardíacas) e para síndrome da fadiga crônica (SFC), também chamada de encefalomielite miálgica (EM) em um estudo subjetivo, aberto, não cego, não randomizado e não cruzado.[12]
d-Ribose suplementar ignora parte da via das pentoses-fosfato, uma via de produção de energia, para produzir d-ribose-5-fosfato. A enzima glicose-6-fosfato desidrogenase (G-6-PDH) é frequentemente escasso nas células, mas mais ainda nos tecidos doentes, como em células miocardiais em pacientes com doença cardíaca. O fornecimento de d-ribose na mitocôndria está diretamente correlacionado com a produção ATP; suprimento reduzido de d-ribose reduz a quantidade de ATP sendo produzida. Estudos sugerem que a suplementação d-ribose após isquemia tecidual (e.g. isquemia miocárdica) aumenta a produção de ATP miocardial, e, portanto, função mitocondrial. Essencialmente, administrar d-ribose suplementar ignora uma etapa enzimática na via da pentose fosfato, fornecendo uma fonte alternativa de 5-fosfo-d-ribose 1-pirofosfato para a produção de ATP. d-Ribose suplementar na recuperação de níveis de ATP ao mesmo tempo que reduz a lesão celular em humanos e outros animais. Um estudo sugeriu que o uso de d-ribose suplementar reduz a instância de angina em homens com doença arterial coronariana diagnosticada.[13][14][15] d-Ribose tem sido usado para tratar muitas condições patológicas, como síndrome da fadiga crônica, fibromialgia e disfunção miocárdica. Também é usado para reduzir sintomas de cãibras, dor, rigidez, etc. após exercícios e para melhorar o desempenho atlético.[16][17][18]
Uso em atividade física
[editar | editar código-fonte]A ribose é comumente utilizada durante a atividade física como complemento para estimular a imediata produção de ATP pelas células musculares, permitindo aos músculos continuarem a trabalhar de forma otimizada.
Estudos mostram que as reservas de ATP podem decrescer de 60% a 70% durante exercícios exaustivos e podem levar mais de 72 horas para serem adequadamente repostas.
A ribose consegue aumentar os estoques intramusculares de ATP porém, não consegue melhorar a performance atlética, segundo Dhanoa e Housner (2007),[19]
Ver também
[editar | editar código-fonte]Referências
- ↑ Merck Index, 11th Edition, 8205.
- ↑ a b c Hoffman, Ronald; Benz, Edward J.; Silberstein, Leslie E.; Heslop, Helen E. (2018). «Signaling Transduction and Metabolomics». Hematology: Basic Principles and Practice 7 ed. [S.l.]: Elsevier. pp. 68–78. ISBN 9780323357623. doi:10.1016/B978-0-323-35762-3.00007-X
- ↑ Mahoney, Diane E.; Hiebert, John B.; Thimmesch, Amanda; Pierce, John T.; Vacek, James L.; Clancy, Richard L.; Sauer, Andrew J.; Pierce, Janet D. (2018). «Understanding D-Ribose and Mitochondrial Function. Advances in Bioscience and Clinical Medicine». Advances in Bioscience and Clinical Medicine. 6 (1). doi:10.7575/aiac.abcmed.v.6n.1p.1
- ↑ Bork, Peer; Sander, Chris; Valencia, Alfonso (1993). «Convergent evolution of similar enzymatic function on different protein folds: The hexokinase, ribokinase, and galactokinase families of sugar kinases». Protein Science. 2 (1): 31–40. PMC 2142297
. PMID 8382990. doi:10.1002/pro.5560020104
- ↑ Park, Jae; Gupta, Radhey S. (2008). «Adenosine kinase and ribokinase – the RK family of proteins». Cellular and Molecular Life Sciences. 65 (18): 2875–2896. PMC 11131688
Verifique
|pmc=(ajuda). PMID 18560757. doi:10.1007/s00018-008-8123-1 - ↑ Dr. Jürg Hunziker, (16 de junho de 1999). «Kohlenhydratchemie. 2.1.3. Konformation». dcb-server.unibe.ch (em alemão). UNI-Bern. Consultado em 5 de junho de 2008. Arquivado do original em 24 de janeiro de 2009
- ↑ «PDRHealth.com». Herbal Remedies, Supplements A-Z Index. PDR, LLC. Cópia arquivada em 11 October 2008 Verifique data em:
|arquivodata=(ajuda) - ↑ a b c Hamlow, Lucas; He, Chenchen; Fan, Lin; Wu, Ranran; Yang, Bo; Rodgers, M. T.; Berden, Giel; Oomens, J. (June 2015). Structual [sic] Effects of Cytidine 2'-Ribose Modifications as Determined by Irmpd Action Spectroscopy. 70th International Symposium on Molecular Spectroscopy. University of Illinois Urbana-Champaign. Bibcode:2015isms.confEMI13H. doi:10.15278/isms.2015.MI13 Verifique data em:
|data=(ajuda) - ↑ a b Evich, Marina; Spring-Connell, Alexander M.; Germann, Markus W. (27 de janeiro de 2017). «Impact of modified ribose sugars on nucleic acid conformation and function». Heterocyclic Communications. 23 (3): 155–165. ISSN 2191-0197. doi:10.1515/hc-2017-0056
- ↑ Peacock, Hayden; Fucini, Raymond V.; Jayalath, Prasanna; Ibarra-Soza, José M.; Haringsma, Henry J.; Flanagan, W. Michael; Willingham, Aarron; Beal, Peter A. (2011). «Nucleobase and Ribose Modifications Control Immunostimulation by a MicroRNA-122-mimetic RNA». Journal of the American Chemical Society. 133 (24): 9200–9203. PMC 3116021
. PMID 21612237. doi:10.1021/ja202492e
- ↑ Omran, Heyder; McCarter, Dean; St Cyr, John; Lüderitz, Berndt (2004). «ᴅ-Ribose aids congestive heart failure patients». Experimental & Clinical Cardiology. Summer (9(2)): 117–118. PMC 2716264
. PMID 19641697
- ↑ Teitelbaum, Jacob E.; Johnson, Clarence; St Cyr, John (26 de novembro de 2006). «The use of ᴅ-ribose in chronic fatigue syndrome and fibromyalgia: a pilot study.». The Journal of Alternative and Complementary Medicine. 12 (9): 857–862. CiteSeerX 10.1.1.582.4800
. PMID 17109576. doi:10.1089/acm.2006.12.857
- ↑ «Ribose». wa.kaiserpermanente.org. 7 de outubro de 2019. Cópia arquivada em 3 March 2021 Verifique data em:
|arquivodata=(ajuda) - ↑ Pauly DF, Pepine CJ. D-Ribose as a supplement for cardiac energy metabolism. J Cardiovasc Pharmacol Ther. 2000 Oct;5(4):249-58. doi: 10.1054/JCPT.2000.18011. PMID: 11150394.
- ↑ Li, S., Wang, J., Xiao, Y., Zhang, L., Fang, J., Yang, N. ... Qin, H. (2021). D‑ribose: Potential clinical applications in congestive heart failure and diabetes, and its complications (Review). Experimental and Therapeutic Medicine, 21, 496. DOI: 10.3892/etm.2021.9927
- ↑ Yang, Yunfei; Yang, Jingwei. PESQUISA SOBRE A CAPACIDADE DE EXERCÍCIO AERÓBIO E ANAERÓBIO DO ATLETA COM NUTRIÇÃO BALANCEADA. Rev Bras Med Esporte 27 (4) • Oct-Dec 2021.
- ↑ Seifert JG, Brumet A, St Cyr JA. The influence of D-ribose ingestion and fitness level on performance and recovery. J Int Soc Sports Nutr. 2017 Dec 20;14:47. doi: 10.1186/s12970-017-0205-8. PMID: 29296106; PMCID: PMC5738882.
- ↑ Halit Harmancı, Muhammed M. Atakan, Mert Kayhan, Dilara Kuru, Filiz Özyiğit, Fulden Küçük. Effect of low-dose acute ribose supplementation prior to and during repeated sprint exercise on anaerobic performance and blood lactate level. Turkish Journal of Sports Medicine. Issue: 2023, Volume 58, Issue 4 Page: 155-161 DOI: 10.47447/tjsm.0765
- ↑ Dhanoa TS, Housner JA.Ribose: more than a simple sugar?Curr Sports Med Rep. 2007 Jul;6(4):254-7.