Cortisol
| Cortisol | ||
|---|---|---|
 | ||
 | ||
| Nombre (IUPAC) sistemático | ||
| (11β)-11,17,21-trihydroxypregn-4-ene-3,20-diona | ||
| Identificadores | ||
| Número CAS | 50-23-7 | |
| Código ATC | A01AC03 A07EA02; C05AA01 D07AA02; D07XA01; H02AB09; S01BA02; S01CB03; S02BA01 | |
| Código ATCvet | QD07AC16 (En forma de aceponato) | |
| PubChem | 5754 | |
| DrugBank | DB07886 | |
| ChemSpider | 5551 | |
| UNII | WI4X0X7BPJ | |
| KEGG | D00088 | |
| ChEBI | 17650 | |
| Datos químicos | ||
| Fórmula | C21H30O5 | |
| Peso mol. | 362,460 | |
|
O=C4\C=C2/[C@]([C@H]1[C@@H](O)C[C@@]3([C@@](O)(C(=O)CO)CC[C@H]3[C@@H]1CC2)C)(C)CC4
| ||
|
InChI=1S/C21H30O5/c1-19-7-5-13(23)9-12(19)3-4-14-15-6-8-21(26,17(25)11-22)20(15,2)10-16(24)18(14)19/h9,14-16,18,22,24,26H,3-8,10-11H2,1-2H3/t14-,15-,16-,18+,19-,20-,21-/m0/s1
Key: JYGXADMDTFJGBT-VWUMJDOOSA-N | ||
| Sinónimos | Hidrocortisona | |
| Datos clínicos | ||
| Cat. embarazo | C | |
| Estado legal | ℞-only (EUA) | |
| Vías de adm. | Tabletas orales, intravenosa, tópica | |
El cortisol (hidrocortisona) es una hormona esteroidea, o glucocorticoide, producida por la capa fascicular de la corteza de la glándula suprarrenal.[1] Se libera como respuesta al estrés y a un nivel bajo de glucosa en la sangre. Sus funciones principales son incrementar el nivel de azúcar en la sangre (glucemia) a través de la gluconeogénesis, suprimir el sistema inmunológico y ayudar al metabolismo de las grasas, proteínas y carbohidratos.[2] Además, disminuye la formación ósea. Varias formas sintéticas de cortisol se usan para tratar una gran variedad de enfermedades diferentes.
En el ser humano, estudios cinéticos de la conversión del colesterol libre del plasma en cortisol han demostrado que, en esencia, todo el cortisol secretado deriva del colesterol circulante en condiciones basales y como resultado de la estimulación aguda con adrenocorticotropina (ACTH).
Fisiología
[editar]Producción y secreción
[editar]El cortisol es secretado y almacenado en la zona fascicular de la corteza adrenal, una de las dos partes de la glándula suprarrenal. Esta liberación está controlada por el hipotálamo, una parte del cerebro, en respuesta al estrés o a un nivel bajo de glucosa en la sangre. La secreción de la hormona liberadora de corticotropina (CRH) por parte del hipotálamo desencadena la secreción de la hipófisis de la hormona suprarrenal corticotropina (ACTH); esta hormona es transportada por la sangre hasta la corteza suprarrenal, en la cual desencadena la secreción de glucocorticoides.
La secreción de cortisol está gobernada por el ritmo circadiano de la hormona adrenocorticotropa (ACTH); aumenta significativamente tras despertar, debido a la necesidad de generar fuentes de energía (glucosa) después de largas horas de sueño; aumenta significativamente también al atardecer, ya que esto nos produce cierto estrés.[cita requerida] El cortisol se une a proteínas en el plasma sanguíneo, principalmente a la globulina fijadora de cortisol (CBG) y un 5% a la albúmina; el resto, entre 10 y 15% se encuentra circulando libre. Cuando la concentración del cortisol alcanza niveles de 20-30 µg/dL en la sangre, la CBG se encuentra saturada y los niveles de cortisol plasmáticos aumentan velozmente.[3]
La vida media del cortisol es de 60 a 90 minutos, aunque tiende a aumentar con la administración de hidrocortisona, en el hipertiroidismo, la insuficiencia hepática o en situaciones de estrés.
Principales funciones en el cuerpo
[editar]Las funciones principales del cortisol en el cuerpo son:
- Metabolismo de hidratos de carbono, proteínas y grasas (acción glucocorticoide).
- Homeostasis del agua y los electrólitos (acción mineralcorticoide).
- Incrementar el nivel de glucosa en la sangre a través de la gluconeogénesis.
- Suprimir la acción del sistema inmunitario.
Sin embargo, uno de los efectos del cortisol es que disminuye la formación ósea, pudiendo generar problemas de crecimiento. El cortisol (hidrocortisona endógena) se usa para tratar varias dolencias y enfermedades como la enfermedad de Addison, la Hiperplasia suprarrenal congénita, enfermedades inflamatorias, reumáticas y alergias. La hidrocortisona es un corticoide de baja potencia, disponible sin receta en algunos países, que se utiliza de forma tópica para tratar afecciones cutáneas que no presentan un componente inflamatorio importante, tales como eczemas, eritemas, entre otros.
El cortisol previene la liberación en el cuerpo de sustancias que causan inflamación (prostaglandinas y leucotrienos). Estimula la gluconeogénesis, la descomposición de las proteínas y las grasas para proporcionar metabolitos que pueden ser convertidos en glucosa en el hígado. A diferencia de los otros esteroides suprarrenales, ejerce un control por retroalimentación negativa sobre la síntesis de ACTH, inhibiendo su formación con la supresión de su transcripción genética en la hipófisis.
Pautas y ritmos de secreción
[editar]Los niveles de cortisol secretados en la corteza suprarrenal y disponibles en el organismo son distintos a lo largo del día y puede advertirse en ellos un patrón circadiano. Las mediciones realizadas en saliva y otros líquidos biológicos a diferentes horas del día muestran variaciones diurnas de la hormona (test de variación diurna de cortisol, TVDC). Así se objetivan recuentos más altos de cortisol por la mañana (aproximadamente a las 8 horas), que se mantienen con una disminución discreta hasta el ocaso, momento en el que experimentan un pico transitorio, al que sigue una depresión significativa con mínimos durante la noche y la madrugada o , 3 a 5 horas después de la aparición del sueño. La información sobre el ciclo luz/oscuridad se transmite desde la retina hasta el núcleo supraquiasmático del hipotálamo. Estas pautas no están presentes al nacer (las estimaciones de cuándo se inician varían entre dos semanas y nueve meses).[4]
Se han observado alteraciones en los niveles de cortisol en relación con niveles anormales de ACTH, trastornos físicos y psíquicos, eventos vitales estresantes, y factores de estrés fisiológico (disnea, fiebre, dolor, palpitaciones, deshidratación, traumatismos, etc.). Las concentraciones de la hormona se ven afectadas, tanto por factores endógenos, cuanto por los cambios ambientales en los ámbitos biológico y psicosocial.
Niveles normales (Cortisol basal)
[editar]Los siguientes datos son ejemplos de los niveles de cortisol al comienzo del día (teóricamente sobre las 9) de diferentes laboratorios u hospitales del mundo. Por tanto, coincide con una muestra aleatoria de un nivel de cortisol matutino.[5]
- Australia:
- Estado basal: 200-650 nmol/L
- USA:
- nivel de AM: 4.0-22.0 µg/dL
- nivel de PM: 3.0-17.0 µg/dL
- UK:
- Hospital 1: nivel de cortisol basal >150 nmol/L.
- Hospital 2: rango de referencia del cortisol a las 9am 200-600 nmol/L.
Nota: si bien no se puede dar ningún factor de conversión directo para la correlación de µg/dL a nmol/L respecto a las estimaciones de cortisol en plasma o suero, una aproximación puede ser adquirida mediante la aplicación de un factor de 29,8, por lo que 10 µg/dL es muy parecido a 298 nmol/L.
Efectos
[editar]El cortisol es liberado en respuesta al estrés y actúa para restablecer la homeostasis. Sin embargo, la secreción prolongada de cortisol en altas cantidades, en casos de estrés crónico o hipersecreción de ACTH (síndrome de Cushing), da lugar a importantes cambios fisiológicos.[6]
Insulina
El cortisol contrarresta la insulina, contribuyendo a la hiperglucemia a través de la estimulación de la gluconeogénesis hepática y la inhibición de la utilización periférica de la glucosa[7] con la disminución de la translocación de transportadores de glucosa a la membrana celular,[8] especialmente el GLUT4. Sin embargo, el cortisol aumenta la síntesis de glucógeno (glucogénesis) en el hígado.[9] El efecto permisivo de cortisol en la acción de la insulina en la glucogénesis hepática se observa en el cultivo de hepatocitos en el laboratorio, aunque el mecanismo es desconocido.
Colágeno
En ratas de laboratorio, la pérdida de colágeno inducida por el cortisol en la piel es diez veces mayor que en cualquier otro tejido.[10][11] El cortisol (como opticortinol) puede inhibir inversamente las células precursoras de IgA en el intestino de los terneros.[12] El cortisol también inhibe el IgA en suero, como lo hace la IgM, pero no está demostrado que inhiba la IgE.[13]
Secreción gástrica y renal
El cortisol estimula la secreción ácida gástrica.[14] Su único efecto directo sobre la excreción del ion hidrógeno de los riñones es la estimulación de la excreción del ion amonio mediante la inactivación de la enzima glutaminasa renal.[15] La secreción de cloruro neta en los intestinos es disminuida inversamente por el cortisol in vitro (metilprednisolona).[16]
Sodio
El cortisol inhibe la pérdida de sodio a través del intestino delgado de los mamíferos.[17] El agotamiento del sodio, sin embargo, no afecta al cortisol,[18] por lo que el cortisol no puede ser usado para regular el suero sódico. Originariamente, el objetivo del cortisol puede haber sido transportar sodio; esta hipótesis se soporta en el hecho de que los peces de agua dulce utilizan el cortisol para estimular el sodio hacia el interior, mientras que los peces de agua salada tienen un sistema basado en el cortisol para expulsar el exceso de sodio.[19]
Potasio
La carga de sodio aumenta la intensidad de la excreción del potasio mediante el cortisol, de la misma forma que lo hace la corticosterona.[20] Para que el potasio salga de la célula, el cortisol hace entrar un número igual de iones sodio.[21] Como podemos ver, esto debería hacer que la regulación del pH fuese mucho más simple, al contrario que en la situación normal de falta de potasio donde aproximadamente 2 iones sodio entran por cada 3 iones potasio que salen, que es más cercano al efecto de la desoxicorticosterona. Sin embargo, el cortisol sistemáticamente causa la alcalosis del suero, mientras que en una deficiencia de pH no cambia. Quizás este puede ser el objetivo de llevar el pH del suero a un valor óptimo para algunas de las enzimas inmunológicas durante las infecciones en los momentos en los que el cortisol disminuye. La pérdida directa de potasio en los riñones también es bloqueada mediante el descenso de la concentración de cortisol (9-α-fluorhidrocortisona).[22]
Agua
El cortisol también actúa como una hormona antidiurética.[17] La mitad de la diuresis intestinal es controlada así. En los perros, la diuresis de los riñones es controlada igualmente por el cortisol y el descenso de la excreción de agua sobre el descenso de cortisol (dexametasona) es debido probablemente a la estimulación inversa de la hormona antidiurética (ADH o arginina vasopresina), cuya estimulación no es anulada mediante la carga de agua.[23] Los humanos y otros animales también usan este mecanismo.[24]
Cobre
Es probable que el incremento de la disponibilidad de cobre con fines inmunológicos sea la razón de que muchas enzimas de cobre sean estimuladas hasta una extensión que suele ser el 50% de su potencial total por el cortisol.[25] Esto incluye a la lisil oxidasa, una enzima que se usa para el “cross-linking” del colágeno y la elastina.[26] La estimulación de la superóxido dismutasa por el cortisol es particularmente valiosa para el sistema inmunológico,[27] ya que esta enzima de cobre es usada por el cuerpo para permitir que el superóxido envenene las bacterias. El cortisol causa un descenso de 4 o 5 veces en la concentración de metalotioneínas, una proteína de almacenamiento de cobre en ratones[28] (sin embargo los roedores no sintetizan el cortisol por sí mismos). Esta puede existir para proporcionar más cobre en la síntesis de ceruloplasmina o para liberar el cobre molecular. El cortisol tiene un efecto opuesto sobre el ácido α-aminoisobutírico que sobre otros aminoácidos.[29] Si el ácido α-aminoisobutírico es usado para transportar cobre a través de la pared celular, esta anomalía puede ser posiblemente explicada.
Sistema inmune
El cortisol puede debilitar la actividad del sistema inmune evitando la proliferación de células T. Para ello, vuelve a las T productoras de interleucina-2 insensibles a la interleucina-1 (IL-1) e incapaces de producir el factor de crecimiento de las células T.[30] El cortisol también tiene un efecto negativo sobre la interleucina-1.[31] La IL-1 debe de ser especialmente útil para combatir algunas enfermedades; sin embargo, las endotoxinas bacterianas han conseguido ventaja forzando al hipotálamo a incrementar los niveles de cortisol mediante la secreción de la hormona CRH, en este caso antagonizando la IL-1. Las células supresoras no son afectadas por el factor modificador de la respuesta glucoesteroide GRMF,[32] así que el punto efectivo para las células inmunes puede ser incluso más alto que el punto de procesos psicológicos. Esto refleja la redistribución de los leucocitos hacia ganglios linfáticos, médula ósea y piel. La administración aguda de corticosterona (el receptor agonista endógeno de los tipos I y II) o RU28362 (un receptor agonista de tipo II específico) sobre animales con adrenalina induce cambios en la distribución de los leucocitos. Las células NK (Natural Killer) no son afectadas por el cortisol.[33]
Metabolismo óseo
Baja la formación ósea, así que favorece el desarrollo de osteoporosis a largo plazo.[34] El cortisol saca el potasio de las células a cambio de un número igual de iones sodio como se ha mencionado antes. Esto puede causar un gran problema con la hiperpotasemia del shock metabólico debido a cirugía, ya que el cortisol reduce la absorción de calcio en el intestino.[35]
Memoria
El cortisol coopera con la epinefrina (adrenalina) para crear recuerdos a corto plazo de acontecimientos emocionales; este es el mecanismo propuesto de almacenamiento de recuerdos “flashbulb”, y pueden originarse como un medio para recordar qué evitar en el futuro. Sin embargo, la exposición al cortisol a largo plazo acarrea daños en células del hipocampo,[36] que provocan un aprendizaje dañado.
Efectos adicionales
- Incrementa la presión sanguínea incrementando la sensibilidad de la vasculatura a la epinefrina y la norepinefrina. En ausencia de cortisol, ocurre la vasodilatación generalizada.
- Inhibe la secreción de la hormona liberadora de corticotropina (CRH), causando la retroalimentación de la inhibición de la secreción de la ACTH (hormona adrenocorticotropina o corticotropina). Algunas investigaciones opinan que este sistema de retroalimentación normal puede volverse irregular cuando los animales están expuestos a estrés crónico.
- Permite a los riñones producir orina hipotónica.
- Desconecta el sistema reproductivo, resultando en un incremento de la probabilidad de un aborto no provocado y, en algunos casos, infertilidad temporal. La fertilidad vuelve después de que los niveles de cortisol se hayan reducido de nuevo a los niveles normales.[37]
- Tiene efectos antiinflamatorios mediante la reducción de la secreción de histamina y estabilizando las membranas lisosomales. La estabilización de las membranas de los lisosomas previene de su ruptura, previniendo así el daño de los tejidos sanos.
- Estimula la detoxificación hepática induciendo a la triptófano oxigenasa (para reducir los niveles de serotonina en el cerebro), glutamina sintetasa (reduce los niveles de glutamato y amoníaco en el cerebro), citocromo P-450 hemoproteina (moviliza el ácido araquidónico) y metalotioneínas (reduce los metales pesados en el cuerpo).
- Además de los efectos causados por la unión del cortisol al receptor del glucocorticoide, por su similitud molecular a la aldosterona, también se une al receptor del mineralcorticoide. La aldosterona y el cortisol tienen afinidad similar al receptor mineralcorticoide, sin embargo, los glucocorticoides circulan aproximadamente 100 veces más que el nivel de los mineralcorticoides. Existe una enzima en las dianas de los mineralcorticoides para prevenir la sobreestimulación de glucocorticoides y permitir la actividad selectiva de los mineralcorticoides. Esta enzima, la 11-β-hidorxiesteroide deshidrogenasa tipo II (Proteína: HSD11B2), cataliza la desactivación de glucocorticoides a 11-dehidro metabolitos.
- Hay relaciones potenciales entre el cortisol, el apetito y la obesidad.[38]
Unión
[editar]La mayoría de sueros de cortisol (todos menos un 4%) están unidos a proteínas incluyendo a la globulina fijadora de cortisol (CBG), y a la albúmina sérica. El cortisol libre solo está disponible para los receptores.
Regulación
[editar]El control primario del cortisol es el péptido de la glándula pituitaria, la hormona adrenocorticotrópica (ACTH). La ACTH probablemente controla el cortisol controlando los movimientos de calcio dentro de las células diana de secreción de cortisol.[39] La ACTH es controlada a su vez por el péptido hipotalámico, la hormona liberadora de corticotropina (CRH), que está bajo el control nervioso. La CRH actúa sinérgicamente con la arginina vasopresina, angiotensina II y epinefrina.[40] Cuando los macrófagos activados empiezan a secretar interleuquina-1 (IL-1), que con la CRH aumenta sinérgicamente la ACTH,[31] las células T también secretan glucoesteroides respondiendo al factor modificante (GRMF o GAF) también como a la IL-1, cualquiera de los dos aumenta la cantidad de cortisol requerido para inhibir casi todas las células inmunes.[32] Por lo tanto las células inmunes no pierden toda la batalla por el sinergismo de la interleuquina-1 con la CRH.[41] El cortisol tiene un efecto de retroalimentación negativa en la interleuquina-1[42] que debe ser especialmente útil para las enfermedades que ganan ventaja forzando al hipotálamo a que secrete demasiada CRH, como por ejemplo la bacteria endotoxina. Las células inmunosupresoras no son afectadas por la GRMF,[32] por lo que el punto de referencia eficaz para las células inmunes puede ser incluso mayor que el punto de referencia para procesos psicológicos. La GRMF (llamada GAF en su referencia) afecta primariamente al hígado antes que a los riñones por algunos procesos psicológicos.[43]
Una media alta de potasio, que estimula la secreción de aldosterona in vitro, también estimula la secreción de cortisol de la zona fasciculada de las glándulas suprarrenales en perros;[44] a diferencia de la corticoesterona, en la que el potasio no tiene ningún efecto.[45] En humanos, la sobrecarga de potasio aumenta la ACTH y el cortisol.[46] Esta es sin duda la razón por la que la deficiencia de potasio crea la disminución del cortisol (que acabamos de mencionar) y porque una deficiencia de potasio causa un decrecimiento en la conversión de 11-deoxicortisol a cortisol.[47] Esto probablemente contribuye al dolor en la artritis reumatoide ya que el potasio de la célula está siempre bajo en esta enfermedad.[48]
Factores que, generalmente, reducen los niveles de cortisol
[editar]- La suplementación de magnesio reduce los niveles de cortisol sérico después del ejercicio aeróbico, pero no en entrenamiento de resistencia.[49]
- Ácido graso omega 3, en una dosis de forma dependiente (pero no significativamente), puede reducir la liberación de cortisol influenciada por el estrés mental suprimiendo la síntesis de interleuquina-1 y 6 e intensificando la síntesis de interleuquina-2, donde el primero estimula más la liberación de CRH. Los ácidos grasos omega 6, por otro lado, actúan inversamente en la síntesis de interleuquina.
- La terapia musical puede reducir los niveles de cortisol en algunas situaciones.
- El masaje terapéutico.
- Recientemente, las investigaciones en neurociencia han demostrado que la gestión del estrés mediante la meditación y el mindfulness ayuda a estabilizar los niveles de cortisol en el organismo.
- Las relaciones sexuales.
- La risa y la experiencia humorística.[50]
- La fosfatidilserina derivada de la soja interactúa con el cortisol pero la dosis correcta todavía no está clara.[51]
- La Vitamina C puede despuntar ligeramente la liberación de cortisol en respuesta a un estresante mental.[52]
- El té negro puede acelerar la recuperación de una condición de cortisol alta.[53][54]
Factores que, generalmente, aumentan los niveles de cortisol
[editar]- La cafeína.[55]
- La falta de sueño.[56]
- El ejercicio físico intenso (alto VO2 max.) o prolongado estimula la liberación de cortisol para aumentar la gluconeogénesis y mantener la glucosa en sangre.[57] Una nutrición adecuada y alto nivel de condicionamiento[58] puede ayudar a estabilizar la liberación de cortisol.
- La variación Val/Val del gen BDNF en hombres, y la variación Val/Met en mujeres asociada con el aumento del cortisol salival en una situación estresante.
- El hipoestrogenismo y suplementación de melatonina aumenta los niveles de cortisol postmenopausal en mujeres.
- El estrés está asociado con altos niveles de cortisol.[59]
- Traumas severos o eventos estresantes pueden elevar los niveles de cortisol en la sangre por periodos prolongados.[60]
- El tejido adiposo subcutáneo regenera cortisol de cortisona.[61]
- La anorexia nerviosa puede estar asociada con el incremento del nivel de cortisona.[62]
- El receptor de la serotonina 5HTR2C está asociado con el aumento de la producción de cortisol en hombres.[63]
Química clínica
[editar]- Hipercortisolismo: Niveles excesivos de cortisol en la sangre. (Véase síndrome de Cushing).
- Hipocortisolismo (insuficiencia adrenal): Niveles insuficientes de cortisol en la sangre.
La relación entre el cortisol y ACTH, y los consecuentes trastornos, son de la siguiente manera:
| ACTH en el plasma | |||
|---|---|---|---|
| ↓ | ↑ | ||
| Cortisol en el plasma | ↑ | Hipercortisolismo primario (síndrome de Cushing) | Hipercortisolismo secundario (tumor pituitario o ectópico, síndrome de Cushing, pseudo-Cushing) |
| ↓ | Hipocortisolismo secundario (tumor pituitario, síndrome de Sheehan) | Hipocortisolismo primario (enfermedad de Addison, Hiperplasia Suprarrenal Congénita síndrome de Nelson) | |
Un estudio de 2010 describe el cortisol sérico como un marcador de riesgo de mortalidad en pacientes con síndrome coronario agudo.[64][65]
Farmacología
[editar]Hidrocortisona es el término farmacéutico que designa al cortisol usado para administración oral, inyección intravenosa o aplicación tópica. Se utiliza como inmunosupresor, administrado mediante inyección como tratamiento a reacciones alérgicas graves, como la anafilaxia y el angioedema, en lugar de prednisolona en pacientes que necesitan tratamiento con esteroides y no pueden tomar medicación oral. Se utiliza también como peri-operatorio en pacientes con síndrome de Addison e Hiperplasia suprarrenal congénita sometidos a un tratamiento a largo plazo con esteroides. Puede ser usado tópicamente para reacciones alérgicas, eczemas, psoriasis y otras condiciones de inflamación cutánea. También puede ser inyectada en articulaciones inflamadas debido a enfermedades como la gota.
En comparación con la prednisolona, hidrocortisona posee 1/4 del poder antiinflamatorio, mientras que la dexametasona es aproximadamente 40 veces más fuerte que la hidrocortisona. Para los efectos secundarios, consultar corticosteroide y prednisolona.
Las cremas y los ungüentos de hidrocortisona se pueden comprar sin receta en dosis que van desde 0.05% a 2.5%, dependiendo de las regulaciones locales. Las formas más fuertes están disponibles sólo con receta. Cubrir la piel después de la aplicación aumenta la absorción y el efecto. Dicho incremento a veces es prescrito, pero en otros casos debe ser evitado para prevenir sobredosis e impactos sistémicos.
La publicidad para el complemento dietético CortiSlim (tanto el original como el falso) afirmó que contribuye a la pérdida de peso mediante el bloqueo de cortisol. El fabricante fue multado con 12 millones de dólares por la Comisión Federal de Comercio en 2007 por publicidad engañosa.[66]
Bioquímica
[editar]Biosíntesis
[editar]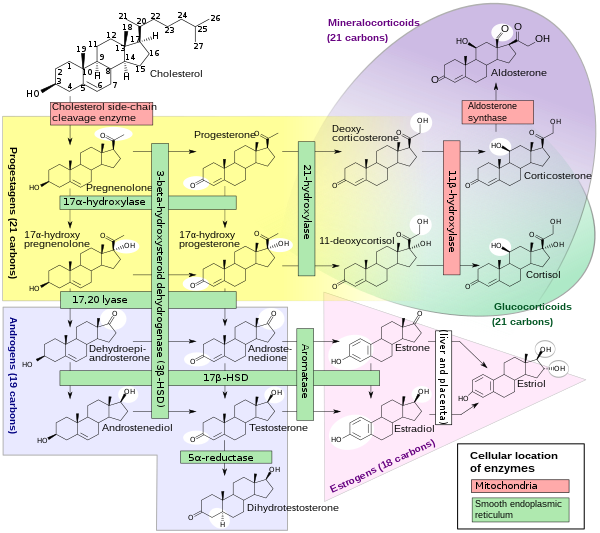
El cortisol es sintetizado a partir del colesterol. La síntesis tiene lugar en la zona media de la corteza suprarrenal (zona fasciculada), lo que da origen a su nombre (cortisol proviene de “cortex”). Aunque la corteza suprarrenal (en la zona glomerulosa) y algunas hormonas sexuales (en la zona reticular) también producen aldosterona, el cortisol es su secreción principal. La médula de la glándula suprarrenal se encuentra bajo la corteza secretando principalmente catecolaminas, adrenalina (epinefrina) y noradrenalina (norepinefrina) bajo estimulación simpática.
La síntesis de cortisol en la glándula suprarrenal es estimulada por el lóbulo anterior de la glándula pituitaria mediante la hormona adrenocorticotropica (ACTH), a su vez estimulada por la hormona liberadora de corticotropina (CRH) que el hipotálamo libera. La ACTH incrementa la concentración de colesterol en la membrana mitocondrial interna a través de la regulación de la STAR (proteína reguladora de la respuesta esteroidal aguda). Además, la ACTH estimula el principal paso limitante en la síntesis de cortisol donde el colesterol es convertido en pregnenolona, catalizado por el Citocromo P450SCC (“Side Chain Cleavage enzyme”, enzima de hendidura de la cadena lateral).[67]
Metabolismo
[editar]El cortisol es metabolizado por el sistema 11 beta hidroxiesteroide deshidrogenasa (11-β-HSD), que consta de dos enzimas: 11-βHSD1 y 11-βHSD2:
- La 11-βHSD1 utiliza el cofactor NADPH para convertir cortisona biológicamente inerte en cortisol biológicamente activo.
- La 11-βHSD2 utiliza el cofactor NAD+ para convertir el cortisol en cortisona.
En general, el efecto neto es que la 11-β-HSD1 sirve para aumentar las concentraciones locales de cortisol biológicamente activo en un determinado tejido, mientras que la 11-β-HSD2 sirve para disminuir las concentraciones locales de cortisol biológicamente activo.
El cortisol también se metaboliza en 5-α-tetrahidrocortisol (5-α-THF) y 5-β-tetrahidrocortisol (5-β-THF), reacciones para las que la 5-α-reductasa y 5-β-reductasa son los factores que limitan la velocidad respectivamente. La 5-β-reductasa es también un factor limitante de la velocidad en la conversión de cortisona para tetrahidrocortisona (THE).
Se ha sugerido que una alteración en la 11-β-HSD1 puede desempeñar un papel en la patogénesis de la obesidad, la hipertensión y la resistencia a la insulina, a veces denominado síndrome metabólico.[68]
Una alteración en la 11-β-HSD2 se ha visto implicada en la causa de la hipertensión esencial y se sabe que conduce al Síndrome de Exceso Aparente de Mineralocorticoides (SAME).
Neurogénesis
[editar]Esta hormona y sus alteraciones se han relacionado con la neurogénesis, especialmente en adultos, lo cual a su vez se ha visto como uno de los factores incidentes en la depresión humana.[69]
Véase también
[editar]- Prueba de estimulación con ACTH
- Adrenalina
- Catecolamina
- Prueba de la supresión de la dexametasona
- Hormona liberadora de hormona adrenocorticotropa
- Síndrome de Cushing
- Eje hipotalámico-hipofisario-adrenal
- Hipopituitarismo
- Oxitocina
- Trastorno por estrés postraumático
Referencias
[editar]- ↑ "themedicalbiochemistrypage.org">https://web.archive.org/web/20101128140158/http://themedicalbiochemistrypage.org/images/adrenalsteroidsynthesis.jpg
- ↑ First Aid USMLE Step 1 2009, Tao Le et al.
- ↑ Katzung, Bertram G. (2007). «Chapter 39. Adrenocorticosteroids & Adrenocortical Antagonists». Basic & Clinical Pharmacology (9 edición). McGraw-Hill. ISBN 0071451536.
- ↑ de Weerth C, Zijl R, Buitelaar J (2003). «Development of cortisol circadian rhythm in infancy». Early Hum Dev 73 (1-2): 39-52. PMID 12932892. doi:10.1016/S0378-3782(03)00074-4.
- ↑ [1] Archivado el 30 de agosto de 2010 en Wayback Machine., Tests in Addisons
- ↑ «Cortisol and Stress: How Cortisol Affects Your Body, and How To Stay Healthy in the Face of Stress». Stress.about.com. Archivado desde el original el 1 de noviembre de 2012. Consultado el 14 de junio de 2010.
- ↑ USMLE Step 1 Secrets. 2003. p. 63.
- ↑ King, Michael W. (2005). Lange Q&A USMLE Step 1 (Sixth edición). New York: McGraw-Hill, Medical Pub. Division. p. 82. ISBN 0071445781.
- ↑ Baynes, J., Dominiczak, M., Medical Biochemistry. Elsevier Limited; Third Edition (2009). ISBN 978-0-323-05371-6.
- ↑ Houck JC, Sharma VK, Patel YM, Gladner JA. Induction of collagenolytic and proteolytic activities by anti-inflammatoes this by inhibiting collagen formation, decreasing amino acid uptake by muscle, and inhibiting protein synthesis.
- ↑ Manchester, K.L., “Sites of Hormonal Regulation of Protein Metabolism. p. 229”, Mammalian Protein [Munro, H.N., Ed.]. Academic Press, New York. On p273.
- ↑ Husband AJ, Brandon MR, Lascelles AK (octubre de 1973). «The effect of corticosteroid on absorption and endogenous production of immunoglobulins in calves». Aust J Exp Biol Med Sci 51 (5): 707-10. PMID 4207041. doi:10.1038/icb.1973.67.
- ↑ Posey WC, Nelson HS, Branch B, Pearlman DS (diciembre de 1978). «The effects of acute corticosteroid therapy for asthma on serum immunoglobulin levels». J. Allergy Clin. Immunol. 62 (6): 340-8. PMID 712020. doi:10.1016/0091-6749(78)90134-3.
- ↑ Soffer, L.J.; Dorfman, R.I.; Gabrilove, J.L,. “The Human Adrenal Gland”. Febiger, Phil.
- ↑ Kokshchuk, G.I.; Pakhmurnyi, B.A. (1979) “Role of Glucocorticoids in Regulation of the Acid-Excreting Function of the Kidneys”. Fiziol. Z H SSR I.M.I.M. Sechenova 65: 751,.
- ↑ Tai YH, Decker RA, Marnane WG, Charney AN, Donowitz M (mayo de 1981). «Effects of methylprednisolone on electrolyte transport by in vitro rat ileum». Am. J. Physiol. 240 (5): G365-70. PMID 6112881.
- ↑ a b Sandle GI, Keir MJ, Record CO (1981). «The effect of hydrocortisone on the transport of water, sodium, and glucose in the jejunum. Perfusion studies in normal subjects and patients with coeliac disease». Scand. J. Gastroenterol. 16 (5): 667-71. PMID 7323700. doi:10.3109/00365528109182028.
- ↑ Mason PA, Fraser R, Morton JJ, Semple PF, Wilson A (agosto de 1977). «The effect of sodium deprivation and of angiotensin II infusion on the peripheral plasma concentrations of 18-hydroxycorticosterone, aldosterone and other corticosteroids in man». J. Steroid Biochem. 8 (8): 799-804. PMID 592808. doi:10.1016/0022-4731(77)90086-3.
- ↑ Gorbman, A.; Dickhoff, W.W.; Vigna, S.R.; Clark, N.B.; Muller, A.F,. “Comparative Endocrinology”. John Wiley and Sons, New York.
- ↑ Muller AF Oconnor CM, ed. (1958) “An International Symposium on Aldosterone”, page 58. Little Brown & Co.
- ↑ KNIGHT RP, KORNFELD DS, GLASER GH, BONDY PK (febrero de 1955). «Effects of intravenous hydrocortisone on electrolytes of serum and urine in man». J. Clin. Endocrinol. Metab. 15 (2): 176-81. PMID 13233328. doi:10.1210/jcem-15-2-176.
- ↑ BARGER AC, BERLIN RD, TULENKO JF (junio de 1958). «Infusion of aldosterone, 9-alpha-fluorohydrocortisone and antidiuretic hormone into the renal artery of normal and adrenalectomized, unanesthetized dogs: effect on electrolyte and water excretion». Endocrinology 62 (6): 804-15. PMID 13548099. doi:10.1210/endo-62-6-804.
- ↑ Boykin J, DeTorrenté A, Erickson A, Robertson G, Schrier RW (octubre de 1978). «Role of plasma vasopressin in impaired water excretion of glucocorticoid deficiency». J. Clin. Invest. 62 (4): 738-44. PMC 371824. PMID 701472. doi:10.1172/JCI109184.
- ↑ Dingman, J.F.; Gonzalez-Auvert Ahmed, A.B.J.; Akinura, A. (1965) “Antidiuretic Hormone in Adrenal Insufficiency”. Journal of Clinical Investigation 44: 1041,.
- ↑ Weber, C.E (1984). “Copper Response to Rheumatoid Arthritis”. Medical Hypotheses 15: 333-348, on p337,.
- ↑ Weber, C.E. (1984) “Copper Response to Rheumatoid Arthritis”. Medical Hypotheses 15: 333,.on p334.
- ↑ Flohe, L.; Beckman, R.; Giertz, H.; Loschen, G. “Oxygen Centered Free Radicals as Mediators of Inflammation. p. 405”, Oxidative Stress (Sies H, ed) Academic Press, New York.
- ↑ Piletz JE, Herschman HR (junio de 1983). «Hepatic metallothionein synthesis in neonatal Mottled-Brindled mutant mice». Biochem. Genet. 21 (5-6): 465-75. PMID 6870774. doi:10.1007/BF00484439.
- ↑ Chambers, J.W.; Georg, R.H. and Bass, A.D. (1965) “Effect of Hydrocortisone and Insulin on Uptake of Alpha Aminoisobutyric Acid by Isolated Perfused Rat Liver”. Mol. Pharmacol. 1: 66,.
- ↑ Palacios R., Sugawara I. (1982). «Hydrocortisone abrogates proliferation of T cells in autologous mixed lymphocyte reaction by rendering the interleukin-2 Producer T cells unresponsive to interleukin-1 and unable to synthesize the T-cell growth factor». Scand J Immunol 15 (1): 25-31. PMID 6461917. doi:10.1111/j.1365-3083.1982.tb00618.x.
- ↑ a b Besedovsky, H.O.; Del Rey, A.; Sorkin, E. (1984) "Integration of Activated Immune Cell Products in Immune Endocrine Feedback Circuits." p. 200 in Leukocytes and Host Defense Vol. 5 [Oppenheim, J.J.; Jacobs, D.M., eds]. Alan R. Liss, New York,.
- ↑ a b c Fairchild SS, Shannon K, Kwan E, Mishell RI (febrero de 1984). «T cell-derived glucosteroid response-modifying factor (GRMFT): a unique lymphokine made by normal T lymphocytes and a T cell hybridoma». J. Immunol. 132 (2): 821-7. PMID 6228602.
- ↑ Onsrud M, Thorsby E (1981). «Influence of in vivo hydrocortisone on some human blood lymphocyte subpopulations. I. Effect on natural killer cell activity». Scand. J. Immunol. 13 (6): 573-9. PMID 7313552.
- ↑ Knight, R.P., Jr. Kornfield, D.S. Glaser, G.H. Bondy, P.K. (1955). «Effects of intravenous hydrocortisone on electrolytes of serum and urine in man». J Clin Endocrinol Metab 15 (2): 176-81. PMID 13233328. doi:10.1210/jcem-15-2-176.
- ↑ Shultz TD, Bollman S, Kumar R (junio de 1982). «Decreased intestinal calcium absorption in vivo and normal brush border membrane vesicle calcium uptake in cortisol-treated chickens: evidence for dissociation of calcium absorption from brush border vesicle uptake». Proc. Natl. Acad. Sci. U.S.A. 79 (11): 3542-6. PMC 346457. PMID 6954501. doi:10.1073/pnas.79.11.3542.
- ↑ Mc Auley MM, Kenny RA, Kirkwood TT, Wilkinson DD, Jones JJ, Miller VM (marzo de 2009). «A Mathematical Model of aging-related and cortisol induced hippocampal dysfunction». BMC Neurosci 10 (1): 26. PMC 2680862. PMID 19320982. doi:10.1186/1471-2202-10-26.
- ↑ An Introduction to Behavioral Endocrinology, Randy J Nelson, 3rd edition, Sinauer
- ↑ «Stress Cortisol Connection». Unm.edu. Consultado el 14 de junio de 2010.
- ↑ Davies E. Keyon, C.J.; Fraser, R. (1985) "The role of calcium ions in the mechanism of ACTH stimulation of cortisol synthesis." Steroids 45: 557.
- ↑ Plotsky PM, Otto S, Sapolsky RM (septiembre de 1986). «Inhibition of immunoreactive corticotropin-releasing factor secretion into the hypophysial-portal circulation by delayed glucocorticoid feedback». Endocrinology 119 (3): 1126-30. PMID 3015567. doi:10.1210/endo-119-3-1126.
- ↑ Dvorak, M.; "Plasma 17-Hydroxycorticosteroid Levels in Healthy and Diarrheic Calves." British Veterinarian Journal 127: 372, 1971.
- ↑ Besedovsky, H.O.; Del Rey, A.; Sorkin, E. (1984) "Integration of Activated Immune Cell Products in Immune Endocrine Feedback Circuits." p. 200 in Leukocytes and Host Defense Vol. 5 [Oppenheim, J.J.; Jacobs, D.M., eds]. Alan R. Liss, New York,.
- ↑ Stith RD, McCallum RE (1986). «General effect of endotoxin on glucocorticoid receptors in mammalian tissues». Circ. Shock 18 (4): 301-9. PMID 3084123.
- ↑ Mikosha, A.S.; Pushkarov, I.S.; Chelnakova, I.S.; Remennikov, G.Y.A. (1991) “Potassium Aided Regulation of Hormone Biosynthesis in Adrenals of Guinea Pigs Under Action of Dihydropyridines: Possible Mechanisms of Changes in Steroidogenesis Induced by 1,4, Dihydropyridines in Dispersed Adrenocorticytes.” Fiziol. [Kiev] 37: 60,.
- ↑ Mendelsohn FA, Mackie C (julio de 1975). «Relation of intracellular K+ and steroidogenesis in isolated adrenal zona glomerulosa and fasciculata cells». Clin Sci Mol Med 49 (1): 13-26. PMID 168026.
- ↑ Ueda Y, Honda M, Tsuchiya M, et al. (abril de 1982). «Response of plasma ACTH and adrenocortical hormones to potassium loading in essential hypertension». Jpn. Circ. J. 46 (4): 317-22. PMID 6283190.
- ↑ Bauman K Muller J 1972 “Effect of potassium on the final status of aldosterone biosynthesis in the rat. I 18-hydroxylation and 18hydroxy dehydrogenation. II beta-hydroxylation.” Acta Endocrin. Copenh. 69; I 701-717, II 718-730.
- ↑ LaCelle PL et al. (1964) “An investigation of total body potassium in patients with rheumatoid arthritis.” Proceedings of the Annual Meeting of the American Rheumatism Association, Arthritis and Rheumatism 7; 321.
- ↑ Wilborn, C.D.; Kerksick, C.M.; Campbell, B.I.; Taylor, L.W.; Marcello, B.M.; Rasmussen, C.J.; Greenwood, M.C.; Almada, A.; Kreider, R.B. (diciembre de 2004). «Effects of Zinc Magnesium Aspartate (ZMA) Supplementation on Training Adaptations and Markers of Anabolism and Catabolism». Journal of the International Society of Sports Nutrition (en inglés) 1 (2): 12-20. PMC 2129161. PMID 18500945. doi:10.1186/1550-2783-1-2-12.
- ↑ Berk et al. 22 (1): 946.11. «Cortisol and Catecholamine stress hormone decrease is associated with the behavior of perceptual anticipation of mirthful laughter». The FASEB Journal. Consultado el 14 de junio de 2010.
- ↑ Starks MA, Starks SL, Kingsley M, Purpura M, Jäger R (2008). «The effects of phosphatidylserine on endocrine response to moderate intensity exercise». J Int Soc Sports Nutr 5: 11. PMC 2503954. PMID 18662395. doi:10.1186/1550-2783-5-11.
- ↑ Vitamin C: Stress Buster Psychology today
- ↑ «Black tea 'soothes away stress'». BBC News. 4 de octubre de 2006. Consultado el 30 de abril de 2010.
- ↑ «Journal Article». SpringerLink. Consultado el 14 de junio de 2010.
- ↑ Lovallo WR, Farag NH, Vincent AS, Thomas TL, Wilson MF (marzo de 2006). «Cortisol responses to mental stress, exercise, and meals following caffeine intake in men and women». Pharmacol. Biochem. Behav. 83 (3): 441-7. PMC 2249754. PMID 16631247. doi:10.1016/j.pbb.2006.03.005.
- ↑ «Sleep loss results in an elevation of cortisol levels the next evening». Cat.inist.fr. Archivado desde el original el 23 de mayo de 2010. Consultado el 14 de junio de 2010.
- ↑ Robson PJ, Blannin AK, Walsh NP, Castell LM, Gleeson M (febrero de 1999). «Effects of exercise intensity, duration and recovery on in vitro neutrophil function in male athletes». Int J Sports Med 20 (2): 128-35. PMID 10190775. doi:10.1055/s-2007-971106.
- ↑ Kraemer WJ, Spiering BA, Volek JS, et al. (enero de 2009). «Recovery from a national collegiate athletic association division I football game: muscle damage and hormonal status». The Journal of Strength and Conditioning Research 23 (1): 2-10. PMID 19077734. doi:10.1519/JSC.0b013e31819306f2. Consultado el 24 de junio de 2021.
- ↑ Wingenfeld, K.; Schulz, M.; Damkroeger, A.; Rose, M.; Driessen, M. (marzo de 2009). «Elevated diurnal salivary cortisol in nurses is associated with burnout but not with vital exhaustion». Psychoneuroendocrinology (en inglés) 34 (8): 1144-1151. ISSN 0306-4530. PMID 19321266. doi:10.1016/j.psyneuen.2009.02.015.
- ↑ Advanced Nutrition and Human Metabolism. 2008. p. 247.
- ↑ «Cortisol Release From Adipose Tissue by 11β-Hydroxysteroid Dehydrogenase Type 1 in Humans». Diabetes.diabetesjournals.org. 13 de octubre de 2008. Consultado el 14 de junio de 2010.
- ↑ Haas et al., 10.3945/ajcn.2008.26958. «Body composition changes in female adolescents with anorexia nervosa». American Journal of Clinical Nutrition. doi:10.3945/ajcn.2008.26958. Archivado desde el original el 28 de febrero de 2009. Consultado el 14 de junio de 2010.
- ↑ «New Clues about Genetic Influence of Stress on Men’s Health». Dukehealth.org. Archivado desde el original el 16 de marzo de 2009. Consultado el 14 de junio de 2010.
- ↑ «Serum cortisol predicts increased cardiovascular mortality in patients with acute coronary syndrome». Endocrine-abstracts.org. Consultado el 14 de junio de 2010.
- ↑ Terzolo, M.; Bovio, S.; Pia, A.; Conton, P.A.; Reimondo, G.; Dall'Asta, C.; Bemporad, D.; Angeli, A.; Opocher, G.; Mannelli, M.; Ambrosi, B.; Mantero, F. (2005). «Midnight serum cortisol as a marker of increased cardiovascular risk in patients with a clinically inapparent adrenal adenoma». European journal of endocrinology / European Federation of Endocrine Societies (en inglés) 153 (2): 307-315. PMID 16061838. doi:10.1530/eje.1.01959.
- ↑ Iwata, Edward (5 de enero de 2007). «Diet pill sellers fined $25M». USA Today. Consultado el 26 de octubre de 2008.
- ↑ Mechanism of ACTH action on adrenal cortical cells Archivado el 10 de julio de 2011 en Wayback Machine. Andrew N. Margioris, M.D., and Christos Tsatsanis, Ph.D. Updated: December 4, 2006
- ↑ [2] Tomlinson JW, Walker EA, Bujalska IJ, Draper N, Lavery GG, Cooper MS, Hewison M, Stewart PM. 11beta-hydroxysteroid dehydrogenase type 1: a tissue-specific regulator of glucocorticoid response. Endocr Rev. 2004 Oct;25(5):831-66.
- ↑ *Gerd Kempermann: Neurogénesis en Mente y cerebro, nº19, julio de 2006
https://medlineplus.gov/spanish/druginfo/meds/a682793-es.html
Bibliografía
[editar]- Manual de Fisiología Médica Guyton Hall.Décima Edición. editorial Mc Graw Hill-Interamericana
Enlaces externos
[editar]Wikcionario tiene definiciones y otra información sobre cortisol.
- Dosage Side Effects and Drug Interaction Warnings Archivado el 5 de marzo de 2012 en Wayback Machine.
- Hydrocortisone Medications
- How to stay healthy with Cortisol Archivado el 1 de noviembre de 2012 en Wayback Machine.