Virus de la pesta porcina africana
| African swine fever virus | |
|---|---|
 | |
| Dades | |
| Hoste | |
| Malaltia | pesta porcina africana |
| Taxonomia | |
| Regne | Bamfordvirae |
| Fílum | Nucleocytoviricota |
| Classe | Pokkesviricetes |
| Ordre | Asfuvirales |
| Família | Asfarviridae |
| Gènere | Asfivirus |
| Espècie | African swine fever virus |
| Variacions genòmiques | |
| 22 genotips diferents | |
El virus de la pesta porcina africana (VPPA) és un virus d'ADN bicatenari, de mida gran, de simetria icosaèdrica i amb embolcall extern.[1] Antigament, aquest virus es classificava com a membre de la família Iridoviridae i, actualment, és l'únic membre del nou gènere Asfivirus de la família Asfarviridae. El VPPA es transmet per artròpodes i causa la pesta porcina africana (PPA).[2]
Caracterització
[modifica]La pesta porcina africana (PPA) és una malaltia viral hemorràgica, contagiosa i infecciosa que afecta els porcs domèstics i salvatges de qualsevol edat.[3] La virulència de les soques del virus de la pesta porcina africana (VPPA) varia des de soques altament patògenes que poden arribar a causar el 100% de la mortalitat fins a soques de baixa patogenicitat que poden ser difícils de diagnosticar.[2] Les soques altament patògenes es caracteritzen per provocar febre alta, pèrdua de gana, hemorràgies de la pell i òrgans interns i mort entre 2 i 10 dies després.
La PPA és generalment prevalent i endèmica en els països de l'Àfrica Subsahariana. En el continent europeu és endèmica únicament a Sardenya.[3] Degut a la gran capacitat de propagació del VPPA fa que aquest sigui una de les amenaces infeccioses més importants per a la indústria del porc domèstic a tot el món, causant efectes devastadors en la producció i grans pèrdues econòmiques als països afectats.[2] La malaltia causada pel VPPA es troba inscrita en el Codi Sanitari pels Animals Terrestres de l'Organització Mundial de Sanitat Animal (OIE) i és de declaració obligatòria a l'OIE.[3]
Virologia general
[modifica]Criptograma: D/2: 130-160/12-16: Se/S: I,V/C,I,O,Ve/Ac
Aquest virus presenta un elevat pes molecular, tot i que el seu genoma només en forma una petita part, per tant, aquest fet demostra que presenta una elevada complexitat, la qual es pot veure amb la presència de bastantes capes en el seu embolcall extern.
En ser ADN bicatenari es replica dins el nucli de la cèl·lula.
Afecta tant a vertebrats com a invertebrats.
Es pot transmetre per via congènita, digestiva a través de femtes i/o a través de secrecions i lesions a la pell per contacte directe. També es pot transmetre per vectors com les paparres de l'espècie Ornithodoros moubata.
Aquest virus es sol trobar entre els líquids corporals i en diversos teixits.[4]
Simptomatologia
[modifica]L'evolució d'aquest virus depèn d'una sèrie de factors, principalment, de la virulència del virus i de la resistència de l'animal. Aquesta malaltia pot seguir un curs de tipus sobreagut, agut, subclínic o crònic. La forma sobreaguda de la malaltia, sol presentar la mort sense símptomes anteriors o una lleugera etapa febril. La forma aguda i la subaguda es diferencien per la intensitat i la duració dels símptomes que es caracteritzen per presentar durant els primers dos o quatre dies febre d'entre 40 i 42 °C però que no els origina trastorns, passats aquests dies, apareixen els senyals relacionats amb la febre com l'anorèxia, falta de moviment o moviment vacil·lant, tos, dispnees, tremolors, parexia o debilitat sobretot del terç posterior, atàxia, alteracions gastrointestinals, circulatòries i vasculars. També presenten cianosi a la pell i hemorràgies en òrgans interns, d'intensitat variable que tendeixen a augmentar, afecten sobretot als ganglis limfàtics, ronyons i mucosa gastrointestinal. També es poden observar les mucoses inflamades i envermellides. Pot ser que apareguin lesions a la pell amb àmplies zones necròtiques, úlceres al morro i a les orelles, hematomes escrotals i conjuntivitis. Les lesions a la pell es solen notar sobretot en porcs blancs, als quals se'ls veuen envermellides les extremitats i la zona abdominal. Finalment es dona la mort entre els 12 i els 14 dies en els casos aguts, i als 15 o 20 en els subaguts.[5][6] Els òrgans interns més afectats per aquesta patologia són:[7]
- Melsa.
- Ganglis limfàtics.
- Fetge.
- Ronyó.
- Cor.
En les formes cròniques la simptomatologia gairebé no s'aprecia, només es pot detectar per la pèrdua de pes dels animals. Els animals que superin aquesta patologia es trobaran en un estat o subclínic o crònic i es convertiran en portadors, però no és massa probable. La simptomatologia és molt semblant a la de la pesta porcina clàssica, per tant, s'ha de recórrer a les proves diagnòstiques per diferenciar-les.
Epidemiologia
[modifica]La PPA va ser descrita per primera vegada per Montgomery a Kenya el 1921. Com ja hem vist, aquesta malaltia és endèmica en la major part de l'Àfrica Subsahariana (incloent l'illa de Madagascar) i la major incidència s'observa des l'Equador fins al nord de Transvaal.[8] Des d'Àfrica va arribar a Europa, en concret, a Portugal el 1957 i el 1960 va colonitzar Espanya, França i Bèlgica. A partir d'aquí, el virus va arribar a Amèrica Llatina durant els anys 70 i els anys 80.[1] A Espanya i Portugal l'erradicació completa va portar més de 30 any i durant els brots a Malta i República Dominicana tot el bestiar porcí porcs d'aquests països es van extingir completament.[2] A Europa el VPP continua present a Sardenya i, recentment, s'ha tornat a introduir a Geòrgia el 2007.[1] Molt probablement aquesta última introducció a les fronteres d'Europa és deguda a una infecció a través de carn de porc descarregada d'un vaixell, la qual va ser utilitzada per alimentar a porcs d'aquella zona. Més endavant es va estendre a la regió del Caucas i Rússia.[8] Posteriorment s'ha disseminat cap a altres països d'Europa Oriental. A l'any 2018, la malaltia ha aparegut en porcs domèstic de la Xina i en seglars a Bèlgica.
La PPA, normalment, s'associa amb una alta morbiditat i mortalitat.En les regions endèmiques la taxa de mortalitat ha disminuït i les infecciones cròniques subclíniques cada cop són més freqüents. Aquests porcs amb infeccions cròniques és probable que ocupin un paper important en l'epidemiologia de la PPA, per la persistència de la malaltia en les zones endèmiques i per causar brots esporàdics o la introducció lliure de la malaltia.[9]
Espècies afectades
[modifica]Les espècies susceptibles a ser infectades són el porc (Sus scrofa domestica), el senglar (Sus scrofa), el facoquer africà (Phacochoerus africanus), el porc senglar de riu (Potamochoerus porcus), l'hiloquer (Hylochoerus meinertzhageni) i els pècaris (Tayassu spp.). Les infeccions simptomàtiques es produeixen en els porcs i en els senglars. Les infeccions pel VPPA generalment són asimptomàtiques en el falconer africà, el senglar de riu i l'hiloquer,[10] els quals no tenen un paper important en l'epidemiologia d'aquesta malaltia.[9] Hi ha altres espècies que poden transportar el virus sense símptomes com el pècari de collar (Tayassu tajacu) i el pècari de llavi blanc (Tayassu albirostris), tots dos originaris d'Amèrica.[10] Els reservoris naturals són totes aquestes espècies que no presenten símptomes clínics, a més a més, de les paparres toves (gènere Ornithodoros) perquè es creu que el VPPA és un virus ancestral d'aquests artròpodes.[1] Pel que fa a les espècies que no presenten símptomes no tenen un paper important en l'epidemiologia.
Transmissió
[modifica]La PAA es pot transmetre per contacte directe a través de secrecions i excrecions amb els animals infectats o per contacte indirecte a través de fómites i vectors com les paparres. L'entrada del virus en el porc normalment ocorre per via oronasal, encara que també es pot donar per via cutània (escarificació), subcutània, intramuscular i intravenosa, a causa de la picada de paparres. L'eliminació del virus pot produir-se per totes les vies.
La transmissió per contacte directe generalment es produeix per via oronasal a través de secrecions nasals, saliva, femta, orina, exsudat conjuntival, exsudat genital i ferides sagnants.[2] Es creu que la transmissió per aerosols no és important i només sembla ocórrer quan els porcs es troben en proximitat. El VPAA es pot trobar en tots els teixits i líquids corporals, però els nivells més elevats es troben principalment a la sang. Així, es pot produir una contaminació ambiental massiva si vessa sang durant la necròpsia, quan es produeixen ferides per baralles entre animals o si un porc presenta diarrea amb sang.
Aquest virus també es pot propagar a través de fómites (locals, vehicles, aliments, materials de treball, material quirúrgic, personal, abeuradors, etc.). El VPPA és altament resistent a les condicions climàtiques.[10]
També es propaga a través de la picada de paparres toves Ornithodoros spp. infectades. Ornithodoros erraticus es va identificar per primera vegada com un vector biològic i un reservori del VPPA a Espanya, que va portar a la descobriment que les paparres de Ornithodoros moubata tenen un paper en l'epidemiologia de la malaltia a l'Àfrica. Les paparres Ornithodoros moubata complex són àmpliament distribuïdes al sud d'Àfrica i també són presents a Madagascar i es creu que troben absents a l'Àfrica Occidental.[9] En les poblacions de paparres es pot produir la transmissió transestadial, transovàrica i sexual.[10] Aquestes paparres toves viuen en els caus dels porcs domèstics i salvatges i és allà on mosseguen a individus joves i poden transmetre el VPPA, el qual persisteix en els ganglis limfàtics.[9] La replicació primària té lloc en aquests ganglis limfàtics i, a partir d'aquí, el virus es dissemina per via sangínia i/o limfàtica. A mesura que el virus arriba a diferents òrgans on es produeix la segona replicació, que destrueix el teixit de l'interior dels vasos sanguinis i es produeix hemorràgies.[10] El VPPA es multiplica en les paparres i pot persistir-hi durant molt de temps.[1] Altres insectes xucladors de sang, com ara els mosquits i les mosques, també poden transmetre el virus de forma mecànica.[10]
El període d'incubació és de 5 a 19 dies després del contacte directe amb porcs infectats, però pot ser menor a 5 dies després de l'exposició a les paparres. Generalment, la malaltia aguda apareix en 5 a 7 dies.[2]
El VPPA és molt resistent a la inactivació. A causa de la prolongada persistència del virus en teixits fan que els productes del porc insuficientment congelats, cuinats o curats poden romandre infectats durant diversos mesos i ser una font d'infecció molt important. A més a més, aquest virus pot persistir en l'ambient durant diversos dies.[9]
Mesures de prevenció i control
[modifica]Actualment, no hi ha vacuna ni tractament documentats per la PPA. La prevenció als països lliures de la malaltia depèn de l'adopció de polítiques restrictives d'importació i l'eliminació adequada de les restes de menjar dels avions, vaixells o vehicles procedents de països infectats. A les zones endèmiques és difícil eliminar els reservoris naturals, no obstant això, el control del vector és important per a la prevenció. També és important assegurar-se que no s'utilitzi carn de senglars o d'animals infectats en els aliments dels porcs sensibles. Els programes d'erradicació inclouen un diagnòstic ràpid, sacrifici i eliminació de tots els animals de les explotacions infectades, neteja i desinfecció completes, control d'insectes i paparres i control del moviment i vigilància.[3]
Zones afectades
[modifica]L'anàlisi de diferents virus aïllats va determinar que aquests afecten a individus salvatges molt diferents a l'est i al sud d'Àfrica, reflectint una evolució a llarg temps en poblacions d'hostes separades geogràficament. Gràcies a aïllaments d'aquests virus a partir de porcs domèstics a l'Àfrica occidental i central, Europa, Carib i al Brasil obtinguts durant un període total de 40 anys es va observar com tots estaven fortament relacionats, suggerint que aquest derivaven dels aïllats dels individus de vida salvatge. [11]
Continent Africà
[modifica]Senegal
[modifica]Al Senegal el VPPA va ser identificat per primera vegada el 1959, i des de llavors es van donar freqüents brots del virus i se li va informar a l'Organització Mundial de la Salut Animal (OIE). Des de 1986 s'han documentat un total de 54 brots, 19 dels quals van ser documentats entre els anys 1986-1989 i 15 entre 1999-2003. En aquestes dates la freqüencia dels brots va ser més gran en comparació a la freqüencia d'aparició de casos d'VPPA entre 1989-1998 i 2004-2006 on es va reportar un total de 15 i 5 brots del virus respectivament. El suggeriment que es va fer al Senegal va ser el d'un cicle domèstic d'infecció que afeta les paparres i pot ser la causa de la naturalesa enzoòtica de la malaltia al país. Tot i això, la transmissió per contacte directe sembla el principal cicle d'infecció.
Entre 2002-2007 es van donar 11 casos d'VPPA. [12]
Malawi
[modifica]A Malawi es van dur a terme uns experiments per a determinar la prevalença del VPPA. El virus es va considerar com enzoòtic entre els anys 1981-1986 en la part occidental de la regió central, on els brots eren freqüents. Al sud es van detectar brots de forma intermitent i al nord no es va detectar cap brot important del VPPA. Basant-se en aquestes observacions es va creure que soques del VPPA de baixa virulència eren presents al país, però no es va donar cap prova experimental científica. [12]
Moçambic
[modifica]En el cas de Moçambic, en un estudi realitzat en 1998, es van detectar anticossos del VPPA en porcs sans al districte de Angónia, prop de la frontera amb Malawi, el que indica que aquests porcs van sobreviure un brot. No obstant això, els experiments van mostrar que aquesta resistència no era altament heretable. [12]
Tanzània
[modifica]A Tanzània el VPPA circulant és p72 de genotip II, el qual és idèntic a l'aïllat a Geòrgia en 2007. El brot de VPPA en porcs domèstics va ocórrer al novembre del 2012 al districte de Kyela, a la regió de MBeya, al sud-oest de Tanzània, que va coincidir amb un altre brot al districte veí de Karonga al nord de Malawi. El VPPA es va continuar expandint fins que va arribar a la veïna regió d'Iringa, situada al districte de Ludewa al febrer de 2011 a través de l'alimentació de porcs amb deixalles procedents de Mbeya. Per març del 2011, el virus es va expandir fins a Chunya, Ileje, Mbarali, Rungwe, i Turkuyu, districtes presents dins de la regió de Mbeya. Aquesta malaltia es va expandir per la regió a causa de la falta de mesures zoosanitàries i el tràfic il·legal d'animals. Així doncs, es va donar un brot del VPPA en una granja del districte de Temeke a la regió de Dar es Salaam a l'est de Tanzània al març del 2011 després que un ramader obtingués porcs de Mbeya. En aquesta regió no es van observar més casos després de les mesures preses per a l'erradicació del virus a la zona.
A l'octubre del 2011 la malaltia va passar fins al districte de Sumbawanga a la regió de Rukwa.
Al febrer del 2012 es van documentar casos en Ifakara, present al districte de Kilombero a la regió de Morogoro i al julio del mateix any al districte de Kilosa. [13]
Riscos d'introducció a la Unió Europea
[modifica]Hi ha una advertència de part de la FAO amb motiu d'un risc d'entrada del VPPA des de la federació Russa. És per això perquè La FAO fa una crida a aquells països limítrofs amb la Federació Russa demanant-los que estiguin en alerta màxima de cara a aquest virus i que haurien d'invertir a millorar en la millora de la seva capacitat per detectar i respondre a un brot. Aquesta afirmació ha estat avaluada en una avaluació de riscos publicat per EMPRES Watch (Sistema de prevenció d'emergència). És de ressaltar que aquesta advertència de part de la FAO ha estat present des de l'any 2008.
Segons l'últim bolletí, la FAO reporta que el VPPA es va introduir l'any 2007 a la Federació Russa molt probablement des de Geòrgia. Donada la situació actual (de baixa bioseguretat,), la possibilitat d'erradicar la pesta porcina africana ràpidament de la Federació de Rússia és baixa, i la malaltia "és probable que continuï amenaçant la seguretat alimentària de tota l'Europa de l'Est durant anys, si no dècades per venir'. La FAO identifica el moviment de la carn infectada, la qual es destina per a la mateixa alimentació del sector porcí i esta com la via més probable pel qual el VPPA podrien ser introduïts a “no només els països veïns de la Federació de Rússia, sinó també molt més lluny”. [14] [15] [16]
Morfogènesi
[modifica]El procés de formació de les estructures del virus de la pesta porcina africana té lloc en àrees específiques del citoplasma anomenat la "fàbrica vírica", localitzat a prop del nucli i del centre d'organització de microtúbuls. Quan la morfogènesis comença hi ha un augment gradual de la grandària de la fàbrica, ocupant cada cop més espai al citoplasma. També hi ha una acumulació de mitocondris a la perifèria.
Formació de la capa interna
[modifica]L'acumulació de membranes virals a prop de la fàbrica és la primera indicació que està tenint lloc l'assemblatge d'un virus, aquestes estructures són els precursors de les capes internes de la partícula vírica. Els precursors poden estar presents com a petits estructures obertes i corbes, tot i que també apareixen organitzades paral·lelament separades per material electrodens i de vegades entre les cisternes del reticle endoplasmàtic.
Un altre tipus d'estructura que es pot observar en aquest punt dins i fora dels llocs d'assemblatge (però sempre a prop de la fàbrica vírica) són estructures víriques aberrants amb forma de cremallera. Aquestes consisteixen en proteïnes allargades, de 30 nm de gruix i amb dominis similars a la closca nuclear de la partícula vírica. Aquestes estructures tindran dos membranes lipídiques als costats, les quals seran similars a la capa interna en forma de cremallera trobat dins les fàbriques víriques mentre que als marges dels llocs d'assemblatge hi haurà cisternes del RE amb espais luminals evidents. Per aquest motiu es diu que la capa interna prové de les cisternes del RE col·lapsades i que conté dos membranes oposades unides íntimament.
Per mètodes de senyalització es va veure que les cisternes que es formaven al RE eren reconegudes pels mateixos anticossos que les capes internes de les membranes de les estructures víriques marginals (mateixa procedència). També es va veure que hi havia proteïnes de membrana del RE en membranes que estaven dins de la fàbrica vírica, com a membranes d'intermediaris d'assemblatge, en virions madurs i en virus extracel·lular. Eren tots reconeguts per un anticòs que té afinitat per quatre proteïnes del RE. També hi ha una proteïna de la família multi-gen 110 (ORF XP124L), que codifica una proteïna que es desplaça al lumen del RE, trobada retinguda al lumen després de la síntesi i es va detectar en intermediaris vírics d'assemblatge i en virions madurs. Aquests fets van ser interpretats com que el VPPA s'embolicava per les cisternes del RE, contribuint a donar consistència a la idea que dues membranes estan presents a la capa interna vírica.
En conclusió, les evidències morfològiques i immunoquímiques indiquen clarament que els precursors de les membranes víriques deriven de les cisternes del RE, les quals són reclutades per la fàbrica i modificades.
Formació de la càpside
[modifica]Les anàlisis fetes amb microscopis d'electrons de les fàbriques víriques mostren que la càpside es forma a la part convexa de les membranes víriques, les quals es converteixen en formes polièdriques per forces dependents d'ATP i de calci. A part de la proteïna major de càpside p72, l'assemblatge de la càpside depèn de la proteïna pB602L, que és una proteïna no estructural que actua com una xaperona i que actua com a suport de la proteïna major p72 i de la proteïna pB438L, un component menor de la càpside involucrat probablement en la formació dels vèrtexs d'aquesta.
Formació de la closca nuclear ("core shell")
[modifica]Simultàniament a l'assemblatge de la càpside, la closca nuclear es forma per sota de la part còncava de l'embolcall víric. Aquest domini sembla que està constituït per dos "arranjaments cel·lulars" de subunitats globulars de 10 nm subdividits en capes electrodenses fines. Els principals constituents del domini "core shell" són productes proteolítics de les dues poliproteïnes dels virus, pp220 i pp62. La presència també de la proteasa pS273R en aquest domini i de la distribució subcel·lular de les poliproteïnes i dels seus productes en alguns experiments de "pols-caça" indica que el processament de polipropilè de proteïna s'acobla al conjunt del nucli.
Les poliproteïnes pp220 i les pp62 interaccionen entre elles per formar la closca nuclear per sota la capa interna lipídica. L'expressió d'ambdues proteïnes condueix al tancament de cremallera, que són estructures semblants a les de la closca delimitat a les dues bandes per les membranes de lípids. En canvi, quan s'expressen soles les pp220 s'uneixen als lípids de membrana per la seva fracció N-terminal que dona lloc a les capes denses limitat per una membrana. Per això, és temptador especular que les estructures de cremallera consisteixen en dues unions de membranes contenent pp220 en les capes oposades interconnectades per precursor de pp62, mentre que les cremalleres apareixen preferentment associades a cisternes RE en infeccions de VPPA, estan units principalment a membrana plasmàtica i membranes endolisosomals en els experiments d'expressió transitòria. Aquest fet suggereix que no només l'acilació està involucrada en l'adequada senyalització a la membrana de la proteïna pp220.
Una organització similar a la de les cremalleres també té lloc en el desenvolupament de la closca nuclear de partícules normals del VPPA. Tot i que, a diferència de les cremalleres, la closca nuclear és una estructura asimètrica delimitada a la part externa per una capa lipídica i interiorment per un nucleoide amb un contingut de DNA.
Aquesta diferència podria ser explicada per canvis addicionals estructurals que tenen lloc durant l'assemblatge de la partícula vírica, on la formació del centre i la càpside són processis concomitants. Les cremalleres aberrants constituïdes per poliproteïnes pp220 i pp62 no processades són acumulades en infeccions amb un nombre condicional de virus letals mutants segrestats directament o indirectament en la formació de la càpside. Per tant, sembla probable que l'assemblatge progressiu de la capa de la càpside a l'embolcall intern determina d'alguna manera l'assemblatge adequat d'un centre asimètric per sota l'embolcall.
Formació del nucleòtid
[modifica]La formació del nucleòtid és l'últim pas en la morfogènesi del VPPA. En les fàbriques víriques apareixen partícules icosaèdriques que poden presentar un nucleoide central electrodens. Hi ha dos models per explicar aquest pas:
Un d'ells suggereix que aquests complexes nucleoproteids són pre-formades en la unió de la fàbrica a les membranes a prop de les partícules "buides", i que llavors en un vèrtex són encapsulades dins aquestes partícules. Aquest mecanisme no s'ha confirmat.
El model alternatiu sosté que el DNA viral primer és encapsulat (segurament juntament amb nucleoproteïnes) i llavors és condensat dins el virus en procés de formació per a produir els virions completament formats. A favor d'aquest model s'han descobert alguns detalls de la formació d'aquests virus, com que l'expressió de les lipoproteïnes pp220 i pp62 han mostrat que la incorporació del genoma viral i de les nucleoproteïnes p10 i pA104R a la partícula vírica depèn de l'assemblatge previ de la closca interna.
Tot i així, aquest mecanisme no ha de ser molt efectiu, ja que és freqüent observar partícules víriques "buides".[17]
Interacció amb cèl·lules. Mecanismes d'infecció
[modifica]Entrada del VPPA
[modifica]La via d'entrada determinarà si una infecció serà productiva o no. Perquè aquesta ho sigui haurà d'entrar per les vies respiratòries per poder infectar les vies respiratòries altes i la primera replicació té lloc al teixit limfoide.
L'entrada és deguda a interaccions amb les promotors dels receptors celulars.
Entrada del VPPA dinàmic-dependent i mediat per clatrina
[modifica]Aquesta entrada serà degut a una endocitosi regulada per un conjunt de proteïnes i lípids que són reclutats en una seqüència temporal, aquestes molècules prenen part en la unió de la membrana i la seva elongació, però també en la fissió final de les vesícules endocítiques.
Una part de la membrana plasmàtica de la cèl·lula s'invaginarà creant una petita vesícula intracel·lular recobert per proteïnes adaptadores de clatrina (Epsina15 i Dinamina). Llavors es reclutarà molècules relacionades amb la senyalització de l'actina, aquesta última molècula juntament amb la Dinamina es posaran a la base del coll de la vesícula i provocaran l'escissió de la capa formada pels adaptadors de clatrina i fent que aquesta entri dins de la cèl·lula.
Entrada per macropinocitosos
[modifica]El VPPA també inclou una altra entrada dins de la cèl·lula, que serà per macropinocitosi.
Els microtúbuls durant l'ingrés del VPPA
[modifica]Els virions arriben a la zona perinucler, prop del centre organitzador de microtúbuls, lloc de replicació. Un dels passos més importants en la maduració endosomal inclou la progressió d'aquest endosoma cap a l'àrea perinuclear, i aquesta progressió la realitzen pels microtúbuls. Així doncs, el tràfic d'aquest virus es basa en els microtúbuls, i de fet, per una correcta infecció és necessari el correcte funcionament d'aquests. Per altra banda, l'activació de Rac1, la qual estabilitza els microtúbuls, també és crucial durant la infecció.[18]
VPPA al nucli
[modifica]La transcripció del VPPA comença a utilitzar enzims de processament, que es troben empaquetats en el nucli del virió. Aquests enzims necessiten que la replicació del DNA comenci immediatament després que el virus entri al citoplasma.
El lloc principal de replicació d'aquest virus és al citoplasma, de totes maneres la replicació del VPPA presenta una fase inicial al nucli. De fet el seu ADN es pot trobar en els llocs de replicació del nucli i del citoplasma.
Fragments curts de DNA nuclear viral són sintetitzats a prop de la membrana nuclear, i després, són transportats a la fàbrica de replicació citoplasmàtica. L'ADN que es troba en les partícules virals madures deriva de dos fragments, nuclear i citoplasmàtic.
D'altra banda les proteïnes virals p37 i p14 poden dirigir-se al nucli. Aquestes proteïnes són producte de la pp220, una poliproteïna que es troba a l'escorça nuclear del VPPA. La p37 és transportada al nucli i exportada al citoplasma, i pot estar implicada en el transport nucleocitoplàsmic de l'ADN de VPPA.
Estudis recents diuen que la infecció de VPPA alteren l'organització nuclear en una primera etapa de la infecció.
Estructura genòmica
[modifica]El genoma del virus de la PPA està format per una molècula d'ADN lineal de doble cadena, amb una mida aproximada d'entre 170 -193 Kb. Aquest codifica per uns 151-167 marcs de lectura d'obertura (ORF), i de fet, les diferències en la mida del genoma i el nombre de gens són en gran part a causa del guany i la pèrdua d'aquests ORFs. Hi ha com a mínim 22 genotips diferents d'aquest virus.
Replicació genòmica
[modifica]El virus de la pesta porcina africana es replica al citoplasma, mentre que la síntesi de l'ADN viral té lloc al nucli. Aquest virus té una transcriptasa pròpia i una RNA polimerasa RNA depenent.[19]
En porcs infectats, els monòcits i els macròfags semblen ser les principals cèl·lules diana del virus de la PPA. La replicació del virus provoca l'arrodoniment i la inflamació de les cèl·lules, conjuntament amb la marginació de la cromatina nuclear.
La replicació del virus indueix la necrosi de les cèl·lules afectades i l'alliberament de partícules víriques citoplasmàtiques sense embolcall, que seran observades a la sang, la limfa i el teixit intersticial.[20]
El període d'incubació varia entre 3 i 21 dies, depenent de la ruta d'exposició.[19]
Seguint una infecció oro-nasal o intramuscular, el virus es replica principalment a les cèl·lules fagocítiques mononuclears de les tonsil·les i dels limfonodes mandibulars (o altres limfonodes regionals), estenent-se per la limfa i la sang fins als òrgans de replicació secundaris, on podrà ser detectat durant els 2 – 3 dies posteriors a la infecció (dpi).[20] Quan el virus s'estén per la sang s'anomena virèmia, durant l'inici de la qual encara no es mostren els primers signes clínics.[19]
En aquests òrgans secundaris, la replicació s'observa majoritàriament als macròfags, però durant les fases centrals o finals de la pesta porcina africana aguda (5 – 7 dies posteriors a la infecció), l'evidència de la replicació viral es troba a cèl·lules no-fagocítiques, cèl·lules epitelials i/o cèl·lules mesenquimàtiques, un fenomen que juga un rol menor en la patogènesi de la malaltia.
L'abundant replicació i necrosi observada als macròfags en diversos òrgans condueix a la presència de nombrosos virions lliures al teixit intersticial. Això, juntament amb la destrucció de les cèl·lules diana del VPPA en aquestes àrees, afavoreix la infecció d'altres poblacions de cèl·lules durant fases més tardanes de la malaltia.
Les partícules víriques es poden observar als limfòcits i plaquetes a conseqüència de la replicació del virus als megacariòcits. Aquests elements actuen com a vehicles passius per a la dispersió del virus per tot el cos, ja que tenen una funció similar als eritròcits, però només esdevé evident a les fases més avançades de la malaltia.[20]
Degut a l'absència d'anticossos neutralitzants, la virèmia persisteix durant molt temps, en alguns casos, fins a mesos.[19]
Resposta immune cel·lular
[modifica]El virus de la pesta porcina africana es dirigeix principalment cap a les cèl·lules del llinatge mieloide, especialment els monòcits, els macròfags i les cèl·lules dendrítiques, que són les cèl·lules presentadores d'antígens professionals (APC). Aquestes cèl·lules detecten patògens associats a patrons moleculars (PAMPs) a través de la seva gamma de receptors de reconeixement de patrons (PRRs), com per exemple, els receptors tipus Toll (TLRs), que inicien la resposta immune, secretant citocines i quimiocines i presentant antígens per fagocitosi.[21]
Activació dels macròfags
[modifica]Tant els macròfags infectats com els no infectats mostren canvis morfològics indicatius de l'activació fagocítica, caracteritzada per un increment en la mida de la cèl·lula, la proliferació lisosomal i la presència de restes cel·lulars fagocitades.
Tot i la replicació del virus als macròfags i la seva posterior necrosi, hi ha un augment en el nombre total de macròfags als òrgans en els que es produeix la replicació. Aquest increment es troba associat a una millora de l'activitat secretora dels macròfags.
La necrosi intensa de macròfags només ocorre a l'última fase de la malaltia, quan les lesions característiques de la PPA són ja evidents i els mecanismes patogènics involucrats ja han estat activats.
Els primers signes de febre i l'augment de TNF-α i IL-1 als nivells sèrics apareixen 1 o 2 dies després de la infecció, coincidint amb una elevada expressió de citocines als òrgans limfoides. Això indica que l'inici de la febre i l'augment de la producció de citocines en l'etapa inicial de la malaltia aguda estan lligades a l'activació de diferents poblacions de macròfags a la melsa i als ganglis limfàtics (principalment), i de les cèl·lules de Kupffer del fetge, que també mostren l'expressió d'IL-6 i provoquen la síntesi de proteïnes de fase aguda.
Els macròfags són responsables dels canvis observats als nivells d'IL-8 i d'IL-10:
- L'IL-8 augmenta a partir dels 3 dies posteriors a la infecció, coincidint amb lleus lesions inflamatòries als pulmons, caracteritzades per la presència de neutròfils.
- L'IL-10 té un efecte inhibitori sobre la producció de citocines proinflamatòries. L'increment dels nivells d'IL-10 es detecten als estadis finals de la PPA aguda.[20]
El rol de les cèl·lules NK
[modifica]Les cèl·lules natural killer (NK) tenen un paper molt important en la lluita en contra de les infeccions virals, ja que ataquen i destrueixen de forma directa les cèl·lules infectades pels virus i produeixen citocines (com per exemple, l'interferó γ) i quimiocines. Les cèl·lules NK també interaccionen amb altres limfòcits, millorant la funció de les cèl·lules dendrítiques i induint la seva maduració. A canvi, les cèl·lules dendrítiques augmenten l'activitat de les cèl·lules NK, que també es veu augmentada pels interferons de tipus I secretats per les cèl·lules infectades.
Estudis recents indiquen que les cèl·lules NK tenen un paper important a les respostes antivirals. Les cèl·lules NK són presents en el porc, i s'han descrit com a perforina +CD3+CD4−CD5±CD6−CD8+CD11b+CD16+. Tot i que encara no s'han reportat detalls sobre la naturalesa funcional de les cèl·lules natural killer dels porcs, els limfòcits de porcs proliferen i produeixen IFN γ quan són co-cultivats amb α-galatosylceramida, un estimulador específic de cèl·lules NK.
Es creu que les cèl·lules NK podrien estar involucrades en la producció de IFN γ després de la infecció amb el VPPA. Tot i així, l'elucidació de la funció de les cèl·lules NK en la resposta immune del VPPA requereix més investigació.[21]
Funció de l'interferó γ
[modifica]L'interferó γ (IFN γ), originalment era anomenat factor d'activació dels macròfags, ja que regula a l'alça les funcions dels macròfags, incloent el processament i la presentació d'antígens. Encara que diferents tipus de cèl·lules secreten IFN γ, els principals productors són les cèl·lules T activades i les cèl·lules NK.
L'activació dels macròfags per acció de l'IFN γ augmenta l'activitat i les respostes pro-inflamatòries antimicrobianes directes, com la producció de citocines i quimiocines, i promou la producció d'IFN γ al lloc de la inflamació pels limfòcits reclutats, com ara les cèl·lules NK.
Com que el virus de la pesta porcina africana es dirigeix principalment a les cèl·lules presentadores professionals (macròfags, cèl·lules dendrítiques, ...), l'IFN γ pot tenir un impacte directe en les interaccions entre el VPPA i les cèl·lules hostatgeres, especialment durant les primeres etapes de la infecció pel virus.[21]
Diagnòstic
[modifica]Cal sospitar de pesta porcina africana quan una síndrome molt infecciosa provoca entre un 95 i 100% de mortalitat en porcs de totes les edats amb els signes clínics de la pesta porcina. Les formes més lleus de la malaltia poden ser més difícils de diagnosticar.
En un diagnòstic post-mortem, trobarem múltiples hemorràgies, petèquies als ronyons, nòduls limfàtics hemorràgics (especialment els hepàtics, en casos crònics o salvatges), i infarts esplènics. També cal buscar la confirmació de laboratori. En els avortaments provocats per la pesta porcina africana, és més fàcil demostrar-la en la truja que no pas en el fetus. La placenta és un dels millors productes de l'avortament per al diagnòstic.[22]
És necessari establir un diagnòstic precoç i ràpid per aquesta malaltia per tal de poder eliminar focus el més ràpid possible, evitar la seva difusió i minimitzar les pèrdues. Hi ha diverses maneres de realitzar un diagnòstic per aquesta patologia:[23]
Diagnòstic clínic
[modifica]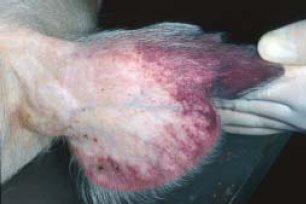
És aquell que valora els símptomes clínics de la malaltia, en aquest cas apareixen al tercer o quart dia de la patologia. Aquests signes van seguits d'una davallada de la temperatura abans de la mort. Inicialment s'observa anorèxia, tristesa i una descoordinació de moviments, per aquest fet, els animals solen estar la majoria del temps estirats de cúbit-lateral a terra i si s'aixequen es comprova la debilitat o falta de moviment en les extremitats posteriors. En les següents 12 o 24 hores de la malaltia, es poden observar exantemes cutanis a conseqüència de les alteracions circulatòries i vasculars. Aquestes taques solen aparèixer a les orelles principalment, però també a les parets abdominals, a les natges i a la base de la cua. També poden aparèixer petèquies. També pot generar hemorràgies de les mucoses, alteracions en l'aparell digestiu i/o en el respiratori.[5]
Diagnòstic anatomopatològic i histològic
[modifica]S'utilitzen per verificar el diagnòstic clínic mitjançant l'observació de diferents òrgans diana. Les més característiques de la Pesta Porcina Africana són:[5]
- Fetge hipertròfic, hemorràgic i amb infiltració limfoide.
- Leucopènia.
- Lesions vasculars en capil·lars i arterioles.
- Oclusió de capil·lars i arterioles.
- Infart esplènic i hemorràgic.
- Petèquies corticals en el ronyó.
- Hemorràgia perifèrica en els ganglis limfàtics.
- Destrucció del nucli dels limfòcits en el teixit limfoide i infiltrat.
Per tant, per portar a terme aquesta proves el més utilitzat són tècniques basades en la immunofluorescència directa, complementades amb la indirecta, de la melsa, ganglis limfàtics, fetge, ronyó, tonsil·les, entre altres, a partir de sèrum o exsudats per poder detectar anticossos. En el cas que nombre de mostres sigui molt elevat, una tècnica més efectiva, per la qual es substitueix és el ELISA.
Aquests dos tipus de diagnòstic presenten l'inconvenient de la similitud entre els símptomes i les lesions entre la Pesta Porcina Africana i la pesta porcina clàssica.
Diagnòstic amb cultius bacteriològics
[modifica]Es sembren bacteris, principalment al fetge i a la melsa, que causen malalties similars en els porcs, per poder establir un diagnòstic diferencial. Un exemple d'aquest bacteris són Pasteurellas, Escherichias.[5]
Diagnòstic biològic per inoculació o prova de la immunitat creuada
[modifica]En porcs hiperimmunitzats per la Pesta Porcina Africana, se'ls inoculen líquids corporals infectats amb aquest virus de porcs morts per aquesta malaltia, per tal de poder determinar si és aquesta o no la malaltia, és a dir, si el porc immunitzat contra aquesta mor, significarà que no és la Pesta Porcina Africana la causant de la mort. És un mètode segur i efectiu, però és costós, perquè obliga a disposar d'instal·lacions, personal i de diversos porcs que han de morir d'una malaltia lenta i dolorosa.[5]
Diagnòstic a través de proves serològiques i virològiques
[modifica]En aquest cas, la millor opció seria portar a terme una combinació de tests que han d'incloure la detecció del genoma viral mitjançant una PCR, la detecció de l'antigen del virus a través de proves com ELISA o proves de fluorescència per anticossos, i l'aïllament del virus. Els països on aquest virus es troba present, generalment, són països en desenvolupament, on les proves que s'utilitzen són ELISA i les de fluorescència perquè són les més barates, però també són menys sensibles.[5][7][24][25]
Aïllament del virus
[modifica]Es pot aïllar de sang i de teixits com la melsa, el fetge, nòduls limfàtics i tonsil·les. La tècnica més utilitzada és la d'hemadsorció.
L'hemadsorció és un tret característic del virus de la pesta porcina africana. Es va descobrir in vitro i posteriorment es va utilitzar per al diagnòstic. Als cultius cel·lulars, els eritròcits apareixen en una disposició tipus corona que envolta les cèl·lules infectades, mentre que in vivo, els eritròcits adquireixen forma de pera i envolten els macròfags i monòcits infectats.
Diagnòstic per hemadsorció
[modifica]Aquesta tècnica es basa en el fenomen d'atracció i fixació específica dels glòbuls vermells sobre els leucòcits transformats per la infecció del virus, expressant la proteïna hemaglutinina que permet aquesta adsorció. La hemadsorció és reversible, ja que després de produir la transformació de la cèl·lula, el virus provoca efectes citopàtics sobre la cèl·lula, és a dir, la lisi d'aquesta, i així es desfan els agregats. Aquesta és una tècnica molt eficaç, fiable i molt utilitzada, perquè permet diferenciar entre els virus de la Pesta Porcina Africana i la Clàssica, ja que el primer dona positiu en la prova i el segon no. Actualment, s'han detectat soques d'aquest virus que no produeixen ni hemadsorció ni efectes citopàtics, per tant, que generen falsos negatius en aquesta prova. Un altre problema d'aquesta tècnica, és que es tarden alguns dies a obtenir els resultats, depenent de si la soca és més o menys virulenta, altrament dit, com més virulent és el virus, més ràpid posa de manifest aquesta propietat. Per aquests problemes, és millor comprovar-ho amb tècniques com la ELISA, la PCR o de fluorescència.
Proves basades en la detecció d'antígens
[modifica]Test de fluorescència mediada per anticossos
[modifica]Aquest test es basa en la detecció microscòpica de l'antigen, per tant, és una prova directa. La majoria d'aquests antígens són intracel·lulars, i per això s'utilitza un fluorocrom associat a anticossos específics, que generen cossos d'intrusió o grànuls fluorescents en el citoplasma de la cèl·lules infectades. Amb aquesta tècnica es resol la identificació dels virus que no presenten hemadsorció. S'ha de tenir en compte, que en la fase aguda de la malaltia aquesta prova té molta sensibilitat, però en fases cròniques o subagudes en perd una part important.

ELISA
[modifica]Aquesta prova mostra la interacció antigen-anticòs amb una prova colorimètrica, per tant, a diferència de l'anterior, és una prova indirecta. La variant més utilitzada s'anomena “Sandwitch ELISA”. Els avantatges d'aquest mètode són que és barat i que no necessita un equipament gaire complex, per tant, es pot utilitzar en la majoria de laboratoris. L'inconvenient més notable que presenta, és que només és recomanable utilitzar-la en fases agudes de la malaltia, ja que és quan hi ha més presència de virus i, per tant, la seva sensibilitat es veu afavorida, però mai serà tan elevada com la de la PCR.
Proves moleculars
[modifica]Per realitzar aquestes proves s'han de seleccionar les àrees del genoma conservades entre els diferents genotips d'aquest virus, però suficientment diferents dels virus de soques relacionades amb aquesta, per evitar reaccions creuades. Aquest fet ha portat a generar noves variants de la PCR que evitin les reaccions creuades amb altres virus que afecten al porc.

PCR convencional
[modifica]Aquesta tècnica permet detectar el genoma del virus en mostres de sang, sèrum i òrgans. El petits fragments de DNA del virus els amplifica fins a quantitats detectables per la PCR. Aquesta prova és una alternativa més sensible, específica i ràpida a l'aïllament del virus, a més dona positiu quan en un aïllament el virus no seria detectat. També és capaç de detectar els 22 diferents genotips coneguts, els virus que no produeixen hemadsorció i és capaç de detectar-los en estats molt inicials de la infecció o en baixes quantitats d'aquests antígens. Un avantatge molt important d'aquesta prova és que es pot utilitzar amb mostres inactivades o degenerades, per tant, pot treballar amb mostres que no es poden utilitzar en les proves d'aïllament, però la seva extremada sensibilitat fa que, en el cas que hi hagi hagut contaminació, doni falsos positius. Només donarà falsos negatius en presència d'inhibidors o àcids nucleics danyats si es treballa amb mostres degradades. És més barata i fàcil de portar a terme que la PCR a temps real, per tant, es pot portar a terme en laboratoris menys preparats.
PCR a temps real
[modifica]Té les mateixes característiques que una prova normal, però amb millores. Aquesta tècnica augmenta la rapidesa, la sensibilitat, redueix les possibilitats de contaminació perquè és un sistema tancat i permet quantificar el resultat. Un altre avantatge és que cada cop és més automàtica. Es pot utilitzar amb proves amb oligonucleòtids i també pot donar lectures fluorescents. Aquesta prova és considerada com la millor i més eficient per fer aquest tipus de diagnòstics.
PCR múltiplex
[modifica]Aquesta prova es basa en els mateixos principis que la PCR convencional però s'utilitza per detectar virus diferents alhora, com per exemple, el virus de la Pesta Porcina Africana i el virus de la Pesta Porcina Clàssica, entre altres. Presenta dues fases, la primera amplifica el DNA de la mateixa manera que ho fa la PCR convencional, i la segona diferencia els genomes dels diferents virus a través de diversos estímuls. El desavantatge més notable d'aquesta prova és que té menys sensibilitat que les anteriors.
Proves isotèrmiques d'amplificació
[modifica]El seu funcionament és igual al de la PCR, però amb una diferència d'equipament, en comptes d'utilitzar el car equipament de termociclat de la PCR convencional, utilitza vapor d'aigua, per tant és una alternativa molt més barata a la PCR, que permet que es pugui utilitzar en laboratoris no tan especialitzats ni equipats, i en laboratoris mòbils. Aquesta prova encara s'ha de millorar en sensibilitat i especificitat.
Vacunació
[modifica]Actualment no existeix cap vacuna per prevenir la pesta porcina africana. Els intents per immunitzar els animals utilitzant formulacions de vacuna preparades per mitjans convencionals i que comprenen extractes infectats, sobrenedants de leucòcits infectats de porc, virions purificats i inactivats, macròfags alveolars infectats, ... han fracassat en el seu objectiu d'induir immunitat protectora.[26]
Atès que els intents originals de vacunació contra el virus de la pesta porcina africana basats en virus atenuats, inactivats i vius no van ésser satisfactoris, alguns nous prototips de vacunes s'han provat experimentalment in vivo. Focalitzant-se en l'alteració de gens específics, com per exemple els gens que codifiquen les proteïnes implicades en l'evasió de la defensa de l'hoste, es poden obtenir resultats prometedors per al futur desenvolupament de vacunes atenuades recombinants en viu més segures.
Tot i que aquesta tecnologia s'ha utilitzat amb èxit per caracteritzar els factors de virulència del virus in vivo, encara no hi ha evidència de què l'ús d'aquests virus recombinants amb fins de vacuna, probablement degut a la virulència residual que conserven.[27]
Vacuna d'ADN
[modifica]Les cèl·lules T tenen un paper essencial en la protecció contra el virus de la PPA. Per tant, una vacuna ideal i efectiva per al futur no només ha d'induir anticossos neutralitzants, sinó que també ha d'induir respostes de cèl·lules T específiques contra el virus de la PPA.
En un intent d'assolir aquest objectiu, s'han dissenyat nombrosos prototips de vacunes utilitzant la immunització d'ADN com una eina per estimular i primar la resposta immune enfront del VPPA amb antígens del virus immunodominants.
Aquests dissenys han servit per entendre diferents conceptes:
- La immunització d'ADN amb un plasmidi que codifica PQ funciona en ratolins però no en els porcs. Això ha generat noves preocupacions sobre l'ús d'animals petits com a models per estudiar la pesta porcina africana.
- Els experiments preliminars d'immunització que utilitzen els pèptids sintètics F3 i F6, a més de l'adjuvant de Freund, confirmen el potencial de protecció d'aquests dos pèptids i suggereixen que és possible obtenir vacunes protectores contra el virus de la PPA mitjançant la incorporació de nous determinants del virus.
A més de les seves capacitats de protecció, la identificació dels pèptids F3 i F6 ha permès l'exploració d'un fenomen immunològic molt interessant que podria tenir implicacions per als futurs dissenys de vacunes: la immunodominància.[21]
Referències
[modifica]- ↑ 1,0 1,1 1,2 1,3 1,4 D. K. Atuhaire, M. Afayoa, S. Ochwo, S. Mwesigwa, J. B. Okuni, W. Olaho-Mukani, and L. Ojok, “Molecular characterization and phylogenetic study of African swine fever virus isolates from recent outbreaks in Uganda (2010-2013).,” Virol. J., vol. 10, no. 1, p. 247, Jan. 2013.
- ↑ 2,0 2,1 2,2 2,3 2,4 2,5 http://www.cfsph.iastate.edu/Factsheets/es/peste_porcina_africana.pdf.
- ↑ 3,0 3,1 3,2 3,3 http://www.oie.int/fileadmin/Home/esp/Media_Center/docs/pdf/Disease_cards/ASF-ES.pdf Arxivat 2014-01-07 a Wayback Machine.
- ↑ http://www.oie.int/fileadmin/Home/eng/Media_Center/docs/pdf/Disease_cards/ASF-EN.pdf Arxivat 2014-06-03 a Wayback Machine.
- ↑ 5,0 5,1 5,2 5,3 5,4 5,5 Borregon, Antonio.Estudio sobre la Peste Porcina Africana en España. Publicaciones científicas ovejero, 1988.
- ↑ http://www.fao.org/docrep/004/X8060E/X8060E00.HTM#ch3
- ↑ 7,0 7,1 Seculi, Jose i Costa, Pedro.Peste Porcina Africana. Real Academia de Medicina de Barcelona, 1962.
- ↑ 8,0 8,1 V. Michaud, T. Randriamparany, and E. Albina, “Comprehensive phylogenetic reconstructions of African swine fever virus: proposal for a new classification and molecular dating of the virus.,” PLoS One, vol. 8, no. 7, p. e69662, Jan. 2013.
- ↑ 9,0 9,1 9,2 9,3 9,4 S. Costard, L. Mur, J. Lubroth, J. M. Sanchez-Vizcaino, and D. U. Pfeiffer, “Epidemiology of African swine fever virus.,” Virus Res., vol. 173, no. 1, pp. 191–7, Apr. 2013.
- ↑ 10,0 10,1 10,2 10,3 10,4 10,5 «PESTE PORCINA AFRICANA» (
PDF) (en castellà). Cresa. Arxivat de l'original el 2014-01-07. [Consulta: 22 novembre 2023].
- ↑ Mahy, Brian WJ, and Marc HV Van Regenmortel, eds. Desk encyclopedia animal and bacterial virology. Access Online via Elsevier, 2010.
- ↑ 12,0 12,1 12,2 E. M. C. Etter, I. Seck, V. Grosbois, F. Jori, E. Blanco, L. Vial, A. J. Akakpo, R. Bada-alhambedji, P. Kone, and F. L. Roger, “Seroprevalence of African Swine Fever in Senegal, 2006,” vol. 17, no. 1, pp. 49–54, 2011.
- ↑ L. Cl, T. M. Hyg, Y. Jf, S. Trop, M. Hyg, F. Js, and T. Jarisch-, “African Swine Fever Virus,” vol. 18, no. 12, pp. 2081–2083, 2012.
- ↑ R. Federation, U. Nations, and E. Watch, “FAO warns Europe of the threat of African swine fever,” no. May, 2013.
- ↑ A. Gogin, V. Gerasimov, A. Malogolovkin, and D. Kolbasov, “African swine fever in the North Caucasus region and the Russian Federation in years 2007 – 2012,” Virus Res., vol. 173, no. 1, pp. 198–203, 2013.
- ↑ L. Mur, B. Martínez-lópez, and J. M. Sánchez-vizcaíno, “Risk of African swine fever introduction into the European Union through transport-associated routes : returning trucks and waste from international ships and planes,” 2012.
- ↑ María L. Salas and Germán Andrés, “African swime fever virus morphogenesis,” Virus Res., vol. 173, no. 1, pp. 29–41, 2013.
- ↑ Covadonga Alonso, Inmaculada Galindo, Miguel Angel Cuesta-Geijo, Marta Cabezas, Bruno Hernaez and Raquel Muñoz-Moreno, “African swime fever virus-cell interactions: From virus entry to cell survival,” Virus Res., vol. 173, no. 1, pp. 42–57, 2013.
- ↑ 19,0 19,1 19,2 19,3 L. K. Dixon, D. a G. Chapman, C. L. Netherton, and C. Upton, “African swine fever virus replication and genomics.,” Virus Res., vol. 173, no. 1, pp. 3–14, Apr. 2013.
- ↑ 20,0 20,1 20,2 20,3 J. C. Gómez-Villamandos, M. J. Bautista, P. J. Sánchez-Cordón, and L. Carrasco, Pathology of African swine fever: the role of monocyte-macrophage., Virus Res., vol. 173, no. 1, pp. 140–9, Apr. 2013.
- ↑ 21,0 21,1 21,2 21,3 H.-H. Takamatsu, M. S. Denyer, A. Lacasta, C. M. a Stirling, J. M. Argilaguet, C. L. Netherton, C. a L. Oura, C. Martins, and F. Rodríguez, Cellular immunity in ASFV responses., Virus Res., vol. 173, no. 1, pp. 110–21, Apr. 2013.
- ↑ Taylor, D. J. Pig diseases. Pig diseases. (Sixth., p. 367). 31 North Birbiston Road, Glasgow. 1979.
- ↑ Seculi, Jose. La lucha contra las pestes porcinas. Ediciones Noticias Neosan.
- ↑ González, Silvia.Inmunorregulacion del virus de la peste porcina africana. Instituto Nacional de Investigación y Tecnologia Agraria y Alimentaria, 1991.
- ↑ C. A. L. Oura, L. Edwards, and C. A. Batten, “Virological diagnosis of African swine fever — Comparative study of available tests,” Virus Res., vol. 173, no. 1, pp. 150–158, 2013.
- ↑ J. M. Escribano, I. Galindo, and C. Alonso, Antibody-mediated neutralization of African swine fever virus: myths and facts., Virus Res., vol. 173, no. 1, pp. 101–9, Apr. 2013.
- ↑ J. M. Argilaguet, E. Pérez-Martín, M. Nofrarías, C. Gallardo, F. Accensi, A. Lacasta, M. Mora, M. Ballester, I. Galindo-Cardiel, S. López-Soria, J. M. Escribano, P. a Reche, and F. Rodríguez, DNA vaccination partially protects against African swine fever virus lethal challenge in the absence of antibodies., PLoS One, vol. 7, no. 9, p. e40942, Jan. 2012.