Lityum nitrat
| |

| |
| Tanımlayıcılar | |
|---|---|
3D model (JSmol)
|
|
| ChemSpider | |
| ECHA InfoCard | 100.029.290 |
PubChem CID
|
|
| RTECS numarası |
|
CompTox Bilgi Panosu (EPA)
|
|
| |
| |
| Özellikler | |
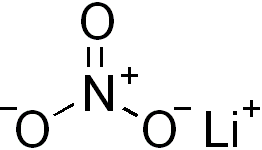
| Molekül formülü | LiNO3 |
| Molekül kütlesi | 68.946 g/mol |
| Görünüm | Beyaz veya açık sarı katı |
| Yoğunluk | 2.38 g/cm3 |
| Erime noktası | 255 °C (491 °F; 528 K) |
| Kaynama noktası | 600 °C (1112 °F; 873 K) Bileşenlerine ayrışır. |
| Çözünürlük (su içinde) | 52.2 g/100 mL (20 °C) 90 g/100 mL (28 °C) 234 g/100 mL (100 °C) |
| Çözünürlük | Etanol, metanol, piridin, amonyak ve asetonda çözünür. |
| Tehlikeler | |
| İş sağlığı ve güvenliği (OHS/OSH): | |
| Ana tehlikeler | Tahriş edici |
| NFPA 704 (yangın karosu) |
|
| Parlama noktası | Yanıcı değildir. |
| Öldürücü doz veya konsantrasyon (LD, LC): | |
LD50 (medyan doz)
|
1426 mg/kg (oral, sıçan) |
| Aksi belirtilmediği sürece madde verileri, Standart sıcaklık ve basınç koşullarında belirtilir (25 °C [77 °F], 100 kPa).
| |
| Bilgi kutusu kaynakları | |
Lityum nitrat LiNO3 formüllü inorganik bileşik. Nitrik asitin lityum tuzudur. Lityum karbonat veya lityum hidroksitin nitrik asit ile reaksiyonundan elde edilir.
Sentez
[değiştir | kaynağı değiştir]Liyum nitrat, nitrik asit ve lityum karbonat tepkimesinden sentezlenebilir.
- Li2CO3 + 2 HNO3 → 2 LiNO3 + H2O + CO2
Genel olarak, LiNO3 oluşumunda bütün asitin ne zaman nötralize olduğunu belirlemek için bir pH indikatörü kullanılır. Ancak, bu nötralizasyon karbondioksit üretiminin kaybolması ile de anlaşılabilir.[1] S onunda oluşan su yığını ısıtılarak uzaklaştırılabilir.
Özellikler
[değiştir | kaynağı değiştir]Termal bileşenlerine ayrışmadan dolayı LiNO3 lityum oksit (Li2O), nitrojen dioksit ve oksijen verir:
- 4 LiNO3 → 2 Li2O + 4 NO2 + O2
Diğer grup nitratlar nitrit tuzu ve oksijen oluşturacak şekilde ayrışır.
Lityum nitrat oldukça iyibir yükseltgendir.[2]
Lityum nitrat sudan yoğundur.[2]
Kaynakça
[değiştir | kaynağı değiştir]- ^ "Synthesis database: Lithium nitrate synthesis". Amateur Science Network. 3 Mart 2016 tarihinde kaynağından arşivlendi. Erişim tarihi: 18 Haziran 2012.
- ^ a b "Chemical Datasheet". CAMEO Chemicals. 21 Mart 2013 tarihinde kaynağından arşivlendi. Erişim tarihi: 26 Nisan 2012.
Dış bağlantılar
[değiştir | kaynağı değiştir]| HNO3 | He | ||||||||||||||||
| LiNO3 | Be(NO3)2 | B(NO3)-4 | RONO2 | NO-3 NH4NO3 |
HOONO2 | FNO3 | Ne | ||||||||||
| NaNO3 | Mg(NO3)2 | Al(NO3)3 | Si | P | S | ClONO2 | Ar | ||||||||||
| KNO3 | Ca(NO3)2 | Sc(NO3)3 | Ti(NO3)4 | VO(NO3)3 | Cr(NO3)3 | Mn(NO3)2 | Fe(NO3)2 Fe(NO3)3 |
Co(NO3)2 Co(NO3)3 |
Ni(NO3)2 | CuNO3 Cu(NO3)2 |
Zn(NO3)2 | Ga(NO3)3 | Ge | As | Se | BrNO3 | Kr |
| RbNO3 | Sr(NO3)2 | Y(NO3)3 | Zr(NO3)4 | Nb | Mo | Tc | Ru(NO3)3 | Rh(NO3)3 | Pd(NO3)2 Pd(NO3)4 |
AgNO3 Ag(NO3)2 |
Cd(NO3)2 | In(NO3)3 | Sn(NO3)4 | Sb(NO3)3 | Te | INO3 | Xe(NO3)2 |
| CsNO3 | Ba(NO3)2 | Hf(NO3)4 | Ta | W | Re | Os | Ir | Pt(NO3)2 Pt(NO3)4 |
Au(NO3)3 | Hg2(NO3)2 Hg(NO3)2 |
TlNO3 Tl(NO3)3 |
Pb(NO3)2 | Bi(NO3)3 BiO(NO3) |
Po(NO3)4 | At | Rn | |
| FrNO3 | Ra(NO3)2 | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| ↓ | |||||||||||||||||
| La(NO3)3 | Ce(NO3)3 Ce(NO3)4 |
Pr(NO3)3 | Nd(NO3)3 | Pm(NO3)3 | Sm(NO3)3 | Eu(NO3)3 | Gd(NO3)3 | Tb(NO3)3 | Dy(NO3)3 | Ho(NO3)3 | Er(NO3)3 | Tm(NO3)3 | Yb(NO3)3 | Lu(NO3)3 | |||
| Ac(NO3)3 | Th(NO3)4 | PaO2(NO3)3 | UO2(NO3)2 | Np(NO3)4 | Pu(NO3)4 | Am(NO3)3 | Cm(NO3)3 | Bk(NO3)3 | Cf | Es | Fm | Md | No | Lr | |||
