Akış pili
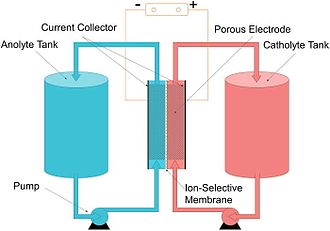
Akış pili veya redoks akış pili, bir zarın iki tarafında sistemden pompalanan sıvılarda çözünmüş iki kimyasal bileşen tarafından kimyasal enerjinin sağlandığı bir tür elektrokimyasal hücredir.[2][3] Hücre içindeki iyon transferi (dış bir devreden elektrik akışı ile birlikte), her iki sıvı da kendi ilgili alanlarında dolaşırken zar üzerinden gerçekleşir. Hücre voltajı kimyasal olarak Nernst denklemi ile belirlenir ve pratik uygulamalarda 1,0 ila 2,43 volt arasında değişir. Enerji kapasitesi elektrolit hacminin, güç elektrotların yüzey alanının bir fonksiyonudur.[4]
İnorganik akış pilleri[5] ve organik akış pilleri dahil olmak üzere çeşitli akış pilleri gösterilmiştir.[6] Her bir kategori altında, akış pili tasarımı ayrıca tam akışlı piller, yarı akışlı piller ve membransız piller olarak sınıflandırılabilir. Konvansiyonel pillerle temel fark, enerjinin geleneksel pillerde elektrot malzemesi, akışlı pillerde ise elektrolitte depolanmasıdır. Akış Pilleri için Patent Sınıflandırmaları, 2021 itibarıyla tam olarak geliştirilmemiştir. Ortak Patent Sınıflandırması, RFB'leri rejeneratif yakıt pilinin bir alt sınıfı olarak değerlendirmektedir (H01M8/18), ancak yakıt pillerini akış pillerinin bir alt sınıfı olarak değerlendirmek daha uygundur.
Akış pilinde, yakıt hücresinde olduğu gibi (burada yeni şarjlı negolit (indirgeyici veya yakıt) ve şarjlı pozolit (oksidan) sisteme eklenir); veya şarj edilebilir bir pil gibi (bir elektrik güç kaynağının indirgeyici ve oksidanın yenilenmesini sağlamasıyla) kullanılabilir. Akış pillerinin, katı elektroaktif malzemelere sahip geleneksel şarj edilebilir pillere göre, güç ve enerjinin bağımsız ölçeklenmesi, uzun döngü ve takvim ömrü, potansiyel olarak daha düşük toplam sahip olma maliyeti gibi belirli teknik avantajları olsa da, tüm akış pilleri düşük döngü enerji verimliliğinden (%50-80) muzdariptir. Bu düşük enerji verimliliği, dahili geçişin etkisini azaltmak (her hücrenin içindeki zar/ayırıcı yoluyla) ve güç maliyetini (yığınların boyutu) azaltmak için akış pillerini yüksek (>= 100 mA/cm2) akım yoğunluklarında çalıştırma ihtiyacından kaynaklanır. Ayrıca çoğu akış pili (Zn-Cl2, Zn-Br2 ve H2-LiBrO3 istisnadır), lityum iyon pillere kıyasla daha düşük özgül enerjiye sahiptir. Fazla ağırlık, çoğunlukla redoks aktif türlerini sıvı fazda tutmak için bir çözücü (genellikle su) kullanma ihtiyacından kaynaklanır.[7]
Tarih
[değiştir | kaynağı değiştir]
Çinko-brom akış pili (Zn-Br2), John Doyle'un 29 Eylül 1879'da başvurusu yapılan US224404 patentiyle[4] en eski akış pili kimyasıdır.[8] Zn-Br2 piller nispeten yüksek özgül enerjiye sahipti ve 1970'lerde elektrikli otomobiller için güç kaynağı olarak gösterildiler.[9]
Estonyalı bir kimyager Walther Kangro, 1950'lerde tam olarak çözünmüş geçiş metali iyonlarına dayanan akış pillerini gösteren ilk kişiydi: Ti–Fe ve Cr–Fe.[10] NASA, Japonya ve başka yerlerdeki bazı guruplar ilk Ti-Fe RFB deneylerinden sonra geliştirme için Cr–Fe kimyasını seçtiler. RFB döngüsü sırasında zamanla değişen konsantrasyonun etkisini azaltmak için, karışık (negolit ve posolitte hem krom hem de demir türleri içeren) solüsyonlar kullanıldı. Cr-Fe kimyasının dezavantajları arasında şunlar yer alır: hidrat izomerizmi (yani elektrokimyasal olarak aktif Cr3+ kloro-kompleksleri ile inaktif hekza-aqua kompleksi arasındaki denge ki bu şelatlayıcı amino-ligandlar eklenerek hafifletilebilir) ve negode üzerinde hidrojen oluşumu (H2 aşırı voltajını artırmak için Pb tuzları ve krom elektrot reaksiyonunu katalize etmek için Au tuzları eklenerek hafifletilir).[11]
1980'lerin sonlarında, Avustralya New South Wales Üniversitesi'nden Sum, Rychcik ve Skyllas-Kazacos,[12] tüm vanadyum RFB kimyasının grafit-sulu asit arayüzünün elektrokimyasal voltaj penceresinde dört oksidasyon durumunun varlığı ve dolayısıyla Cr-Fe RFB'lerde zararlı olan karıştırma seyreltmesinin ortadan kaldırılması gibi avantajlarını gösterdi. UNSW, VRFB'lerle ilgili birkaç patent başvurusunda bulundu ve bu teknoloji Japon, Tayland ve Kanada şirketlerine lisanslandı.[13]
Dalian, (Çin) o zamanlar türünün en büyüğü olan 400 MWh, 100 MW vanadyum akışlı bataryayı çalıştırmaya 2022'de başladı.[14]
Tasarım
[değiştir | kaynağı değiştir]Akış pili, içinde bir veya daha fazla çözünmüş elektroaktif element içeren bir elektrolitin, kimyasal enerjiyi elektriğe tersinir şekilde doğrudan dönüştüren bir elektrokimyasal hücre içinden aktığı, şarj edilebilir bir yakıt hücresidir. Elektroaktif elementler, "bir elektrot reaksiyonunda yer alabilen veya elektrot üzerinde adsorbe edilebilen solüsyondaki elementlerdir." Ek elektrolit harici olarak, genellikle tanklarda depolanır ve genellikle reaktörün hücre (veya hücreleri) içinden pompalanır, ancak yerçekimi besleme sistemleri de bilinmektedir. Akış pilleri, elektrolit sıvısı değiştirilerek veya kullanılmış malzeme yeniden şarj edilmek üzere geri kazanılarak "şarj edilebilir". Birçok akış pili, düşük maliyeti ve yeterli elektriksel iletkenliği nedeniyle karbon keçe elektrotları kullanır, ancak bu elektrotlar, birçok redoks çiftine yönelik düşük içsel aktiviteleri nedeniyle güç yoğunluğunu bir şekilde sınırlar.[15][16]
Başka bir deyişle, bir akış pili, iyonik çözeltinin (elektrolit) hücrenin dışında (elektrotların etrafındaki hücre yerine) depolanması[17] ve elektrik üretmek için hücreye beslenebilmesi özelliğine sahip bir elektrokimyasal hücredir. Üretilebilecek toplam elektrik miktarı, tanklardaki elektrolit hacmine bağlıdır.
Akış pilleri, elektrokimya mühendisliği tarafından belirlenen tasarım ilkelerine tabidir.[18]
Redox (ve daha az ölçüde hibrit) akış pilleri aşağıdaki avantajlara sahiptir:
- Bir maliyet/ağırlık/vb. sağlayan bağımsız enerji (tanklar) ve güç (yığın) ölçeklendirmesi. her uygulama için optimizasyona izin verir.
- Uzun döngü ve takvim ömürleri (çünkü lityum iyon ve ilgili pillerin bozulmasına neden olan katıdan katıya faz geçişleri yoktur)
- Hızlı yanıt süreleri
- "Eşitleme" şarjına gerek yoktur (tüm hücrelerin eşit şarj olmasını sağlamak için bir pilin aşırı şarj edilmesi)
- Zararlı emisyon yok
- Durduğu yerde kendiliğinden boşalma çok az veya hiç yok
- Elektroaktif malzemelerin tam geri dönüşümü
Bazı tipler aynı zamanda kolay şarj durumu tespiti, düşük bakım ve aşırı şarj/aşırı deşarj toleransı sunar.
Yanıcı elektrolitler içermedikleri ve elektrolitler güç yığınından uzakta depolanabildikleri için genellikle güvenlidirler.
Akış pillerinin pillere kıyasla üç ana dezavantajı vardır [19]
- Düşük enerji yoğunluğu (yararlı miktarda enerji depolama için büyük elektrolit depolarına ihtiyacınız vardır)
- Düşük şarj ve deşarj oranları (diğer endüstriyel elektrot işlemlerine kıyasla). Bu, elektrotların ve membran ayırıcıların büyük olması gerektiği anlamına gelir, bu da maliyeti artırır.
- Akış pilleri daha düşük enerji verimliliğine sahiptir; çünkü geçişin (dahili kendi kendine boşalma) etkilerini en aza indirmek ve güç maliyetini azaltmak için daha yüksek akım yoğunluklarında çalışırlar.
Akış pilleri tipik olarak yakıt hücrelerinden daha yüksek, ancak lityum-iyon pillerden daha düşük enerji verimliliğine sahiptir.[20]
Geleneksel akış pilleri
[değiştir | kaynağı değiştir]Redoks (indirgeme-yükseltgenme) hücresi, redoks-aktif türlerin sıvı veya gaz ortamında bulunduğu tersinir bir hücredir. Katı hal difüzyonu veya interkalasyon yerine heterojen elektron transferi kullandıklarından, geleneksel pillerden ziyade yakıt hücrelerine benzerler. Yakıt hücrelerinin pil olarak kabul edilmemesinin ana nedeni, yakıt hücrelerinin, 1800'lerde yanmayan bir elektrokimyasal işlem yoluyla yakıt ve havadan doğrudan elektrik üretme aracı olarak ortaya çıkmış olmasıdır. Daha sonra, özellikle 1960'lar ve 1990'larda, şarj edilebilir yakıt hücreleri (örn. H2O2, NASA'nın Helios Prototipindeki birimleştirilmiş rejeneratif yakıt hücreleri gibi) geliştirildi.
Redoks akış pillerine örnek olarak vanadyum akış pili, polisülfit-bromür pil, demir redoks akış pili (IRFB) ve uranyum redoks akış pili verilebilir. Birçok sistem önerilmiş olmasına rağmen, redoks yakıt hücrelerinin ticari yaygınlığı düşüktür.
Vanadyum akış pilleri, en çok pazarlanan akış pilleridir. Her iki elektrotta da vanadyum kullandıkları için çapraz kontaminasyona uğramazlar. Bununla birlikte, vanadyum tuzlarının sınırlı çözünürlüğü pratikte bu avantajı dengeler. Daha da önemlisi, vanadyum redoks çiftlerinin çalışma voltaj aralığı ile karbon/sulu asit arayüzünün voltaj penceresinin neredeyse mükemmel bir eşleşmesidir. Bu, düşük maliyetli karbon elektrotların dayanıklılığını ve H2 ve O2 evrimleri gibi yan reaksiyonların düşük etkisini garanti ederek rekor uzunlukta takvim ve döngü (15.000–20.000 döngü) ömürleri sağlar ve bu da rekor seviyede düşük enerji maliyeti (LCOE, yani sistem maliyetinin kullanılabilir enerjiye, döngü ömrüne ve gidiş-dönüş verimliliğine bölümü) ile sonuçlanır. Akış pillerinin uzun ömürleri, nispeten yüksek ilk maliyetlerinin (vanadyum, karbon keçeler, çift kutuplu plakalar, membranlar nedeniyle) amorti edilmesini sağlar. VRFB'ler için seviyelendirilmiş enerji maliyeti, kWh başına birkaç on sent veya € sent mertebesinde olup, katı hal pillerinden çok daha düşüktür ve ABD ve AT hükûmet kurumları tarafından belirtilen 0,05 $ ve 0,05 € hedeflerinden çok da uzak değildir.[21] Geniş uygulama için başlıca zorluklar şunlardır: VRFB için ham maddeler olan V2O5 in (> 30$/Kg) kıtlığı ve yüksek maliyetleri; hidrojen ve oksijen evrimi dahil olmak üzere parazit reaksiyonları; çevrim sırasında V2O5 çökelmesi.
Geleneksel akışlı pil kimyaları hem düşük özgül enerjiye (bu onları elektrikli araçlar için çok ağır yapar) hem de düşük özgül güce (bu da onları sabit enerji depolaması için çok pahalı yapar) sahiptir. Bununla birlikte, hidrojen-brom akışlı piller için 1,4 W/cm2 lik yüksek bir güç ve yüksek bir özgül enerji (Tank seviyesinde 530 Wh/kg) güç ve enerji yoğunluğu gösterilmiştir.[22][23]
DARPA SBIR tarafından finanse edilen Influit Energy, 2022'de sulu bir çözelti içinde asılı duran metal oksitten yapılmış, yanıcı olmayan, yüzeyi modifiye edilmiş bir nanoelektroyakıt duyurdu. Malzeme, yüksek konsantrasyonda bile çökelmez ve Lion pillerinden daha yüksek enerji yoğunluğuna sahiptir. Çalışma sıcaklıkları -40 ila 80 °C Lityum, ağır metaller veya nadir toprak elementleri gerektirmezler.[24][25]
Hibrit akışlı piller
[değiştir | kaynağı değiştir]Hibrit akış pili, katı bir katman olarak biriktirilmiş bir veya daha fazla elektroaktif bileşen kullanır. En büyük dezavantaj, katı hal elektrotu kullanmaktan kaynaklanan enerji ve güç kaybıdır. Hücre bir pil elektrodu ve bir yakıt pili elektrodu içerir. Bu tip, elektrot yüzey alanı tarafından sınırlanan bir enerji ye sahiptir. Hibrit akışlı piller, çinko-brom, çinko-seryum, çözünür kurşun-asit,[26] ve demir-tuz akışlı pillerden oluşuyor. Weng ve ark. 1,70 V çalışma voltajına sahip bir vanadyum-metal hidrit şarj edilebilir hibrit akışlı pil bildirdi;[27] bu, sulu elektrolitli şarj edilebilir akışlı piller arasında oldukça yüksek bir değerdir. Bu hibrit pil, karışık bir VOSO4 ve H2SO4 çözeltisinde çalışan bir grafit keçeli pozitif elektrot ve KOH sulu solüsyonunda bir metal hidrit negatif elektrottan oluşuyor. Farklı pH değerine sahip iki elektrolit, bir zar ile ayrılır. Sistem iyi bir tersinirlik ve kulomb (%95), enerji (%84) ve voltajda (%88) yüksek verimlilik gösterdi.
100cm2 elektrotlar ve 10 büyük hücrenin seri olarak çalışması dahil olmak üzere artan akım yoğunluğu ile bu redoks çiftinin daha da iyileştirildiğini bildirdiler.
Dalgalanan simüle edilmiş bir güç girişi kullanan ön veriler, kWh ölçekli depolamaya yönelik uygulanabilirliği test etti.[27] 2016 yılında, yüksek enerji yoğunluğuna sahip bir Mn(VI)/Mn(VII)-Zn hibrit akış bataryası önerildi.
Bir prototip çinko - poliiyodür akış pili, 167'Wh/L (litre başına watt-saat) lik bir enerji yoğunluğu gösterdi. Daha eski çinko-bromür hücreleri 70'e Wh/Lye ulaşmaktaydı. Karşılaştırma için, lityum demir fosfat piller 233 Wh/L depolayabilir. Asidik elektrolit içermemesi, yanmazlığı ve -4 ila 122 °F (-20 ila 50 °C) çalışma aralığı göz önüne alındığında, çinko-poliiyodid pilin diğer akışlı pillerden daha güvenli olduğu iddia edilmektedir. (ağırlık ve yer kaplayacak kapsamlı soğutma devresi gerektirmez.) Çözülmemiş bir sorun, negatif elektrotta membrana nüfuz edebilen ve verimliliği azaltabilen çinko birikmesidir. Zn dendrit oluşumu nedeniyle, Zn-halid piller yüksek akım yoğunluğunda (>20 mA/cm2) ve dolayısıyla sınırlı güç yoğunluğuna sahiptir. ZnI pilin elektrolitine alkol eklemek sorunu çözmeye yardımcı olabilir.[28] Zn/I RFB'nin dezavantajları, iyodür tuzlarının yüksek maliyeti (> 20$/Kg), Zn birikiminin alan sınırlaması ile kapasite, enerji ve gücün kaybıdır.
Akü tamamen boşaldığında, her iki tank da aynı elektrolit çözeltisini tutar: pozitif yüklü çinko (Zn2+) ve negatif yüklü iyodür iyonu, (I- )larının bir karışımı. Şarj edildiğinde, bir tank başka bir negatif iyon, poliiyodür tutar (I-3 ). Batarya, sıvıyı harici tanklardan sıvıların karıştırıldığı yığın alanına pompalayarak güç üretir. Yığının içinde, çinko iyonları seçici bir zardan geçer ve yığının negatif tarafında metalik çinkoya dönüşür.[29] Çinko-iyodür akış pilinin enerji yoğunluğunu daha da artırmak için bromür iyonları (Br–) iyot-bromür iyonları oluşturan serbest iyodu stabilize etmek için kompleks oluşturucu madde olarak kullanılır (I2Br-), şarj depolaması için iyodür iyonlarını serbest bırakmanın bir yolu olarak.[30]
Proton akışlı piller (PFB), bir metal hidrit depolama elektrotunu tersinir bir proton değişim membranı (PEM) yakıt hücresine entegre eder. Enerji şarj sırasında, katı metal hidrit formunda depolanır. Deşarj, sürecinde protonlar ortam oksijeni ile birleşerek elektrik ve su üretir. Lityumdan daha ucuz metaller kullanılabilir ve lityum hücrelerden daha fazla enerji yoğunluğu sağlar.
Organik tipler
[değiştir | kaynağı değiştir]Organik redoks akışlı piller 2009'da ortaya çıktı. Organik redoks akışlı pillerin birincil çekiciliği, aktif bileşenlerin ayarlanabilir redoks özelliklerinde yatmaktadır. 2021 itibarıyla, organik RFB'nin dayanıklılığı düşüktür (ör. takvim, döngü ömrü veya her ikisi). Bu nedenle ticari ölçekte sadece inorganik RFB gösterilmiştir.[31]
Organik redoks akış pilleri sulu ve susuz olarak sınıflandırılabilir.[32][33] Elektrolit çözücü olarak AORFB'ler su kullanırken, NAORFB'ler organik çözücüler kullanır, hibrit olarak da üretilmiş olabilirler. Büyük ölçekli enerji depolamada, daha düşük solvent maliyeti ve daha yüksek iletkenlik, AORFB'lere daha büyük ticari potansiyel sağlamanın yanı sıra güvenlik avantajları sunar. NAORFB'ler bunun yerine çok daha büyük bir voltaj penceresi sağlar ve daha az fiziksel alan kaplar.
pH nötr AORFB'ler
[değiştir | kaynağı değiştir]Tipik olarak destekleyici elektrolit olarak NaCl kullanılarak pH7 koşullarında çalıştırılırlar. Nötr pH koşullarında, organik ve organometalik moleküller, aşındırıcı asit ve alkali koşullarda olduğundan daha kararlıdır. Örneğin, AORFB'lerde yaygın olarak kullanılan bir katolit olan K4[Fe(CN)] pH nötr koşullarda kararlıdır.[34]
AORFB'ler, pH nötr koşullarda anolit olarak metil viologen, katolit olarak 4-hidroksi-2,2,6,6-tetrametilpiperidin-1-oksil, artı NaCL ve düşük maliyetli bir anyon değişim membranı kullandı. Bu MV/TEMPO sistemi muhtemelen AORFB'ler için bildirilen en düşük sermaye maliyeti (180$/kWh) ile en yüksek hücre voltajına (1,25 V) sahiptir. Sulu sıvı elektrolitler, mevcut altyapıyı değiştirmeden mevcut sistemlerin yerini alacak şekilde tasarlanmıştır. 600 milivatlık bir test pili, 20 ila 100 mA/cm2 arasında değişen akım yoğunluklarında yaklaşık yüzde 100 verimlilikle 100 döngü boyunca kararlıydı ve optimum performans 40-50 olarak derecelendirildi.[35][36] Nötr AORFB'ler, aşındırıcı RFB'lerle karşılaştırılabilir elektrokimyasal performans gösterirken, asit veya alkalin AORFB'lerden daha çevre dostu olabilir. MV/TEMPO AORFB'nin enerji yoğunluğu 8,4' Wh/L dir. Viologen tabanlı akış pilleri, esas olarak Liu'nun Utah Eyalet Üniversitesi'ndeki grubu tarafından geliştirilmiştir. 2019'da grup, 10 Wh/L'lik bir enerji yoğunluğunda 1000 döngü boyunca kararlı olan ultra hafif bir sülfonat –viologen/ ferrosiyanür AORFB'yi rapor etti; bu, şimdiye kadarki en kararlı, enerji yoğun AORFB'dir.[37]
Asidik AORFB'ler
[değiştir | kaynağı değiştir]Kinonlar ve türevleri birçok organik redoks sisteminin temelidir.[38][39][40] Bir çalışmada, 1,2-dihidrobenzokinon-3,5-disülfonik asit (BQDS) ve 1,4-dihidrobenzokinon-2-sülfonik asit (BQS) katot, geleneksel Pb/PbSO<sub id="mwAT0">4</sub> bir hibridde anolit oldu. Kinonlar, geleneksel katolitteki bir birim ile karşılaştırıldığında iki birim elektrik yükü kabul eder; bu, böyle bir pilin belirli bir hacimde iki kat daha fazla enerji depolayabileceği anlamına gelir.
Başka biri, 9,10-Antrakinon-2,7-disülfonik asit (AQDS) değerlendirilmiştir. AQDS, sülfürik asitte camsı bir karbon elektrot üzerinde hızlı, tersinir iki elektron/iki proton indirgemesine maruz kalır. Br2 ile kinon/hidrokinon çiftini birleştiren, ucuz karbon elektrotlu bir sulu akış pili Br2/Br-redoks çifti, 13.000' A/m 2 de 6.000'W/ m2' yi aşan bir tepe galvanik güç yoğunluğu verir. Hacimsel enerji yoğunluğu 20' Wh/L nin üzerindeydi. Negatif tarafta antrakinon-2-sülfonik asit ve antrakinon-2,6-disülfonik asit ve pozitif tarafta 1,2-dihidrobenzokinon-3,5-disülfonik asit, tehlikeli Br2 kullanımını önler. Pilin bozulmadan 1.000 döngü sürdüğü iddia edildi.[41] Bu sistem sağlam görünse de düşük hücre voltajı (yaklaşık 0,55 V) ve düşük enerji yoğunluğu (< 4 Wh/L)na sahiptir.
Elektrolit olarak kullanılan hidrobromik asit, daha az toksik bir alkali çözelti (1 M KOH ) ve ferrosiyanür ile değiştirilmiştir.[42] Daha yüksek pH daha az aşındırıcıdır ve ucuz polimer tankların kullanılmasına izin verir. Membrandaki artan elektrik direnci, artan voltajı telafi etti. Hücre voltajı 1.2 idi V.[43][44] Hücrenin verimliliği %99'u aşarken gidiş-dönüş verimliliği %84 olarak ölçüldü. Pil, tahminen en az 1.000 döngülük bir kullanım ömrü sunuyordu. Teorik enerji yoğunluğu 19 Wh/L idi.[45] Ferrosiyanürün Fe(OH)2 veya Fe(OH)3 oluşturmadan yüksek pH'lı KOH çözeltisindeki kimyasal kararlılığının ölçek büyütmeden önce doğrulanması gerekir.
Hem anolit hem de katolitin aynı moleküle entegre edildiği iki işlevli analitler[46] veya kombi-moleküller [47] aynı malzemenin her iki tankta da kullanılmasına izin verir. Bir tankta elektron verici, diğerinde ise elektron alıcıdır. Bunun, geçişin etkisini azaltmak gibi avantajları vardır.[48] Bu nedenle, kinon diaminoantrakinon[48] ve indigo bazlı[46] moleküllerin yanı sıra TEMPO/ fenazin[47] birleştirici moleküller, simetrik redoks akışlı pillerin (SRFB) geliştirilmesi için potansiyel elektrolitlerdir.
Başka bir yaklaşım, verici/alıcı olarak bir Blatter radikalini benimsedi. Suda çözünmemesine rağmen testlerde 275 şarj-deşarj döngüsüne ulaştı.[49]
Alkalin
[değiştir | kaynağı değiştir]Kinon molekülleri, alkali AROFB'lerde anolit olarak kullanılmıştır. Başka bir anolit adayı, (suda çözünürlüğünü artırmak için) yeniden tasarlanan florenondur. Tersine çevrilebilir bir keton (de)hidrojenasyon hücresi, oda sıcaklığında 1.111 şarj döngüsüyle 120 gün boyunca katalizör olmadan %97 kapasiteyi koruyarak kesintisiz olarak çalıştı. Hücre, vanadyum bazlı sistemlerin iki katından fazla enerji yoğunluğu sunar.[50][51] Alkali AORFB'ler için en büyük zorluk, kararlı bir katolit olmamasıdır. Bildirilen tüm alkali AORFB'ler, alkali çözeltilerde ferrosiyanürün stabilite sorunu nedeniyle fazla potasyum ferrosiyanür katoliti kullanır.
Metal-organik akış pilleri, redoks-aktif metallerin özelliklerini iyileştirmek için organik ligandlar kullanır. Ligandlar, EDTA gibi şelatlar olabilir ve elektrolitin, (aksi halde metal sulu komplekslerin çöker) nötr veya alkalin koşullarda olmasını sağlayabilir. Suyun metalle koordinasyonunu bloke ederek, organik ligandlar metal katalizli su parçalama reaksiyonlarını engelleyerek daha yüksek voltajlı tamamen sulu sistemlere yol açabilir. Örneğin, 1,3-propandiamintetraasetat (PDTA) ile koordineli krom kullanımı, ferrosiyanüre karşı 1,62 V ve broma karşı 2,13 V'luk bir rekor hücre potansiyeli verdi.[52] Metal-organik akış pilleri, Lockheed Martin'in Gridstar Flow teknolojisinin arkasındaki teknolojiyi temsil eden koordinasyon kimyası akış pilleri olarak bilinebilir.[53]
Oligomer
[değiştir | kaynağı değiştir]RFB Oligomer redoks türleri, düşük maliyetli membranlar kullanırken elektroaktif türlerin geçişini azaltmak için önerilmiştir. Bu tür redoks-aktif oligomerler, redoksimerler olarak bilinir. Bir sistem, organik polimerler ve selüloz membranlı bir salin solüsyonu kullanır. Prototip, önemli kapasiteyi korurken 10.000 şarj döngüsünden geçti. Enerji yoğunluğu 10 Wh/L,[54] akım yoğunluğu 100 miliamper/cm2 ye ulaştı.[55]
Başka bir oligomer RFB, düşük maliyetli diyaliz membranları ile kombinasyon halinde viologen ve TEMPO redoksimerleri kullanır. Suda çözülmüş işlevselleştirilmiş makromoleküller (akrilik cam veya Strafora benzer) aktif elektrot malzemesidir. Boyut seçici nano gözenekli membran, bir süzgeç gibi çalışır ve geleneksel iyon seçici membranlara göre çok daha kolay ve daha düşük maliyetle üretilir. Küçük karşı iyonların geçmesine izin verirken büyük "spagetti" benzeri polimer moleküllerini tutar.[55] Konsept, geleneksel Nafion membranın yüksek maliyetini çözebilir, ancak suda yüksek çözünürlüğe sahip redoks aktif polimerin tasarımı ve sentezi önemsiz değildir. Şimdiye kadar, oligomer redoks türlerine sahip RFB'ler, alana özgü rekabetçi güç göstermedi. Düşük çalışma akımı yoğunluğunun büyük redoks moleküllerinin içsel bir özelliği olup olmadığı açık değildir.
Diğer çeşitler
[değiştir | kaynağı değiştir]Diğer akış tipi piller arasında çinko-seryum, çinko-brom ve hidrojen-brom pilleri bulunur.
Membransız
[değiştir | kaynağı değiştir]Zarsız bir pil,[56] iki sıvının (enerji depolamak veya serbest bırakmak üzere reaksiyona girdiği) bir kanaldan pompalandığı laminer akışa dayanır. Çözeltiler, çok az karıştırma ile paralel olarak akar. Akış, sıvıları doğal olarak ayırarak bir zar ihtiyacını ortadan kaldırır.
Membranlar, pillerin en maliyetli ve genellikle en az güvenilir bileşenleridir. Bir zarın olmaması, sıvı brom çözeltisi ve hidrojenin kullanılmasına olanak sağlar: bu kombinasyon, zarlar kullanıldığında sorunludur, çünkü zarı yok edebilen hidrobromik asit oluştururlar. Her iki malzeme de düşük maliyetle mevcuttur. Tasarım, iki elektrot arasında küçük bir kanal kullanır. Sıvı brom, kanal boyunca bir grafit katot, hidrobromik asit, gözenekli bir anot altında akar. Aynı zamanda, hidrojen gazı anot boyunca akar. Kimyasal reaksiyon, pili yeniden şarj etmek için tersine çevrilebilir - bu, herhangi bir zarsız tasarım için bir ilktir-. Ağustos 2013'te yayınlanan pil, 0,795'mW/cm2 lik bir maksimum güç yoğunluğu (diğer membransız sistemlere göre üç kat daha fazla güç ve lityum-iyon pillerden bir kat daha yüksek) üretmişti.
2018'de, aynı elektrolit akışlarını birden çok döngü için yeniden şarj edebilen ve yeniden sirküle edebilen makro ölçekli membransız bir redoks akış pili gösterildi. Pil, döngü sırasında yüksek kapasite tutma ve Coulombic verimliliği sergileyen karışmaz organik katolit ve sulu anolit sıvılarına dayanmaktadır.[57]
Nano ağ
[değiştir | kaynağı değiştir]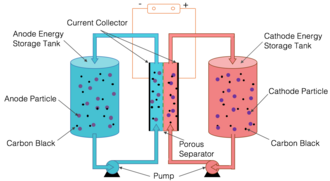
Bir nanoparçacık ağı içinde düzenlenmiş lityum-kükürt sistemi, yükün iletken bir plaka ile doğrudan temas halinde olan parçacıkların içine ve dışına hareket etmesi gerekliliğini ortadan kaldırarak elektriğin sıvı boyunca akmasını ve daha fazla enerji eldesini sağlar.
Yarı katı akışlı bir pilde, pozitif ve negatif elektrotlar, bir taşıyıcı sıvı içinde asılı duran parçacıklardan oluşur. Pozitif ve negatif süspansiyonlar ayrı tanklarda depolanır ve ayrı borulardan ince, gözenekli bir zar gibi bir bariyerle ayrıldıkları bitişik reaksiyon odalarına pompalanır. Yaklaşım, sulu akışlı pillerin temel yapısını, lityum-iyon pillerin kimyasıyla birleştirir.[1][59][60] Karbonsuz yarı-katı redoks akışlı bataryaya bazen Katı Dağılımlı Redoks Akışlı Batarya da denir.[61] Bir malzemenin çözülmesi, kimyasal davranışını önemli ölçüde değiştirir. Bununla birlikte, katı malzeme parçalarının askıya alınması, katının özelliklerini korur. Sonuç, pekmez gibi akan viskoz bir süspansiyondur.[62]
Katı enerji artırıcılar (SEB'ler) olarak da bilinen redoks hedefli katı maddelere (ROTS) sahip akış pilleri, yakın tarihli bir diğer gelişmedir.[63][64][65][66][67][68][69] Bu pillerde, posolit veya negolit veya her ikisi (redoks sıvıları olarak da bilinir), güç yığınının dışındaki tanklarda depolanan bir veya daha fazla katı elektroaktif malzeme ile temas eder. Redoks sıvıları, katı elektroaktif malzemenin redoks potansiyelini çevreleyen redoks potansiyelleri ile bir veya daha fazla redoks çifti içerir. Katı Enerji Arttırıcılara sahip bu tür RFB'ler, geleneksel pillerin (lityum-iyon gibi) yüksek özgül enerji avantajını akış pillerinin ayrıştırılmış enerji-güç avantajıyla birleştirir. SEB(ROTS) RFB'ler, viskoz bulamaçları pompalamaya gerek olmaması, çökelme/tıkanma olmaması, daha yüksek güç, dayanıklılık, daha geniş kimyasal tasarım alanı gibi çeşitli avantajlara sahiptir. Bununla birlikte, çifte enerji kaybı nedeniyle (biri yığında ve diğeri SEB(ROTS) ile bir arabulucu arasındaki tankta), bu tür piller zayıf bir enerji verimliliğine sahiptir. Sistem düzeyinde, geleneksel lityum iyon pillerin pratik özgül enerjisi , lityum iyon pillerin SEB(ROTS)-flow versiyonlarından daha fazladır.[70]
Karşılaştırma
[değiştir | kaynağı değiştir]| Çift | Maks. hücre voltajı (V) | Ortalama elektrot güç yoğunluğu (W/m 2 ) | Ortalama sıvı enerji yoğunluğu | Döngüler |
|---|---|---|---|---|
| Hidrojen – lityum bromat | 1.1 | 15.000 | 750 Wh/kg | |
| Hidrojen – lityum klorat | 1.4 | 10.000 | 1400 Wh/kg | |
| Brom - hidrojen | 1.07 | 7.950 | ||
| Demir – kalay | 0,62 | < 200 | ||
| Demir – titanyum | 0.43 | < 200 | ||
| Demir – krom | 1.07 | < 200 | ||
| demir-demir | 1.21 | < 1000 | 20 Wh/L | 10.000 |
| Organik (2013) | 0.8 | 13.000 | 21.4 Wh/L | 10 |
| Organik (2015) | 1.2 | 7.1 Wh/L | 100 | |
| MV-TEMPO | 1.25 | 8.4 Wh/L | 100 | |
| Sülfonat viologen (NH4)4[Fe(CN)6] | 0.9 | > 500 | 10 Wh/L | 1.000 |
| Metal-organik – ferrosiyanür [52] | 1.62 | 2.000 | 21.7 Wh/L | 75 |
| Metal-organik – brom [52] | 2.13 | 3.000 | 35 Wh/L | 10 |
| Vanadyum-vanadyum (sülfat) | 1.4 | ~800 | 25 Wh/L | |
| Vanadyum-vanadyum (bromür) | 50 Wh/L | 2.000 [2] | ||
| Sodyum-brom polisülfit | 1.54 | ~800 | ||
| Sodyum-potasyum [71] | ||||
| Kükürt-oksijen tuzu [72] | ||||
| çinko-brom | 1.85 | ~1.000 | 75 Wh/kg | > 2.000 |
| Kurşun-asit (metansülfonat) | 1.82 | ~1.000 | ||
| Çinko-seryum (metansülfonat) | 2.43 | < 1.200–2.500 | ||
| Zn-Mn(VI)/Mn(VII) | 1.2 | 60 Wh/L |
Uygulamalar
[değiştir | kaynağı değiştir]Teknik avantajlar, redoks akışlı pilleri büyük ölçekli enerji depolaması için çok uygun bir seçenek haline getirir. Akış pilleri normalde nispeten büyük (1 kWh – 10 MWh), çok saatlik şarj-deşarj döngülerine sahip sabit uygulamalar olarak kabul edilir.[73] Akış pilleri, daha kısa şarj/deşarj süreleri için uygun maliyetli değildir. Akış pili pazarı nişlerine bazı örnekler:
- Şebeke enerji depolama - şebeke tarafından kullanılmak üzere kısa ve/veya uzun vadeli enerji depolama
- Yük dengeleme - yoğun olmayan saatlerde fazla elektrik gücünü depolamak ve yoğun talep dönemlerinde elektrik gücünü serbest bırakmak için akünün bir elektrik şebekesine bağlandığı durum. Bu uygulamada çoğu akış pili kimyasının kullanımını sınırlayan ortak sorun, yüksek bir güç maliyetine dönüşen düşük alan güçleridir (çalışma akımı yoğunluğu).
- Yoğun talep dönemlerinde kullanılmak üzere rüzgar veya güneş gibi kesintili kaynaklardan enerjinin kaydırılması.
- Ani talep artışlarının pil tarafından karşılandığı zirve tıraşı.
- UPS, ana güç kesintisiz bir besleme sağlayamadığında akünün kullanıldığı yer.
- Güç dönüşümü – Tüm hücreler aynı elektrolitleri paylaştığından, elektrolitler belirli sayıda hücre kullanılarak yüklenebilir ve farklı bir sayı ile boşaltılabilir. Pil voltajı kullanılan hücre sayısıyla orantılı olduğundan, pil çok güçlü bir DC-DC dönüştürücü görevi görebilir. Ek olarak, hücre sayısı sürekli olarak değiştirilirse (giriş ve/veya çıkış tarafında), güç dönüşümü de AC/DC, AC/AC veya DC-AC olabilir ve frekansı anahtarlama tertibatının frekansı ile sınırlıdır.
- Elektrikli araçlar – Akışlı piller elektrolit değiştirilerek hızla "şarj edilebildiğinden", aracın içten yanmalı motorlu bir araç kadar hızlı enerji alması gereken uygulamalarda kullanılabilirler. Yaygın sorun, kısa bir sürüş menziline dönüşen düşük enerji yoğunluklarıdır. Çinko klor piller [74] ve yüksek oranda çözünür halojenür içeren piller dikkate değer bir istisnadır.
- Bağımsız güç sistemi – Bunun bir örneği, hiçbir şebeke gücünün bulunmadığı cep telefonu baz istasyonlarıdır. Pil, dalgalanan güç seviyelerini telafi etmek için güneş veya rüzgar enerjisi kaynaklarının yanında ve yakıt tasarrufu için pili en verimli şekilde kullanmak üzere bir jeneratörün yanında kullanılabilir.
Ayrıca bakınız
[değiştir | kaynağı değiştir]- Yakıt hücresi terimleri sözlüğü
- Hidrojen teknolojileri
- Pil türlerinin listesi
- Redoks elektrodu
Kaynakça
[değiştir | kaynağı değiştir]- ^ a b Qi (12 Mayıs 2017). "Review Article: Flow battery systems with solid electroactive materials". Journal of Vacuum Science & Technology B, Nanotechnology and Microelectronics: Materials, Processing, Measurement, and Phenomena. 35 (4): 040801. doi:10.1116/1.4983210. ISSN 2166-2746. Kaynak hatası: Geçersiz
<ref>etiketi: "Qi 040801" adı farklı içerikte birden fazla tanımlanmış (Bkz: Kaynak gösterme) - ^ a b Badwal (24 Eylül 2014). "Emerging electrochemical energy conversion and storage technologies". Frontiers in Chemistry. 2: 79. doi:10.3389/fchem.2014.00079. PMC 4174133 $2. PMID 25309898.
- ^ Alotto (2014). "Redox Flow Batteries for the storage of renewable energy: a review". Renewable & Sustainable Energy Reviews. 29: 325-335. doi:10.1016/j.rser.2013.08.001.
- ^ a b Yuriy V. Tolmachev "Review—Flow Batteries from 1879 to 2022 and Beyond." 2023 J. Electrochem. Soc. 170 030505. https://iopscience.iop.org/article/10.1149/1945-7111/acb8de/meta 8 Şubat 2023 tarihinde Wayback Machine sitesinde arşivlendi.
- ^ Hu, B.; Luo, J.; DeBruler C. (2019). Redox Active Inorganic Materials for Redox Flow Batteries in Encyclopedia of Inorganic and Bioinorganic Chemistry: Inorganic Battery Materials. ss. 1-25. Yazar eksik
|soyadı2=(yardım) - ^ Luo, J. (13 Eylül 2019). "Status and Prospects of Organic Redox Flow Batteries towards Renewable Energy Storage". ACS Energy Lett. 2019, 4 (9): 2220-2240. doi:10.1021/acsenergylett.9b01332. 29 Kasım 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 28 Temmuz 2023.
- ^ Yuriy V. Tolmachev (2022). "Flow batteries with solid energy boosters". Electrochemical Science and Engineering. 12 (4). doi:10.5599/jese.1363.
- ^ "John doyle". 22 Nisan 2023 tarihinde kaynağından arşivlendi.
- ^ C. J. Amato, in "1973 International Automotive Engineering Congress and Exposition", p. 11, 1973-02-01
- ^ W. Kangro Dr, 1949.; W. Kangro Dr, 1954.;W. Kangro and H. Pieper, Electrochim Acta, 7 (4), 435-448 (1962)
- ^ C. Y. Sun and H. Zhang, ChemSusChem, 15 (1), 15 (2022)
- ^ E. R. Sum, M. ; Skyllas-Kazacos, M., J Power Sources, 16 (2), 85-95 (1985); E. S.-K. Sum, M., J Power Sources, 15 (2-3), 179-190 (1985); M. Rychcik and M. Skyllas-Kazacos, J Power Sources, 19 (1), 45-54 (1987); M. Rychcik and M. Skyllas-Kazacos, J Power Sources, 22 (1), 59-67 (1988)
- ^ G. Kear, A. A. Shah, and F. C. Walsh, Int. J. Energy Res., 36 (11), 1105-1120 (2012)
- ^ "World's largest flow battery connected to the grid in China". New Atlas (İngilizce). 3 Ekim 2022. 3 Ekim 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 12 Ekim 2022.
- ^ Aaron (2013). "In Situ Kinetics Studies in All-Vanadium Redox Flow Batteries". ECS Electrochemistry Letters. 2 (3): A29-A31. doi:10.1149/2.001303eel.
- ^ "Advanced Carbon Electrode Materials for Molecular Electrochemistry". Chemical Reviews (İngilizce). 108 (7): 2646-2687. July 2008. doi:10.1021/cr068076m. ISSN 0009-2665. PMID 18557655. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar
|ad1=eksik|soyadı1=(yardım) - ^ "Researchers Drastically Reduce The Cost of Redox Flow Batteries [$25 Per kWh]". TechReportArticles. 29 Ocak 2021. 16 Nisan 2021 tarihinde kaynağından arşivlendi.
- ^ Arenas (June 2017). "Engineering aspects of the design, construction and performance of modular redox flow batteries for energy storage" (PDF). Journal of Energy Storage. 11: 119-153. doi:10.1016/j.est.2017.02.007. 12 Nisan 2021 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 28 Temmuz 2023.
- ^ Tolmachev, Yuriy.
- ^ Xu (2018). ""Evaluation of redox flow batteries goes beyond round-trip efficiency: A technical review"". Journal of Energy Storage. 16: 108-116. doi:10.1016/j.est.2018.01.005.
- ^ Spagnuolo (2016). "Vanadium Redox Flow Batteries: Potentials and Challenges of an Emerging Storage Technology". IEEE Industrial Electronics Magazine. 10 (4): 20-31. doi:10.1109/MIE.2016.2611760.
- ^ Cho (2015). "Cyclic Performance Analysis of Hydrogen/Bromine Flow Batteries for Grid-Scale Energy Storage". ChemPlusChem. 80 (2): 402-411. doi:10.1002/cplu.201402043.
- ^ Tolmachev (2015). "Energy cycle based on a high specific energy aqueous flow battery and its potential use for fully electric vehicles and for direct solar-to-chemical energy conversion". Journal of Solid State Electrochemistry. 19 (9): 2711-2722. doi:10.1007/s10008-015-2805-z.
- ^ Darpa Nanoelectrofuel Flow Battery (İngilizce), 9 Ağustos 2022 tarihinde kaynağından arşivlendi, erişim tarihi: 9 Ağustos 2022
- ^ "Influit moves to commercialize its ultra-high density liquid batteries". New Atlas (İngilizce). 9 Ağustos 2022. 9 Ağustos 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 9 Ağustos 2022. Yazar
|ad1=eksik|soyadı1=(yardım) - ^ Krishna (1 Şubat 2018). "Developments in soluble lead flow batteries and remaining challenges: An illustrated review". Journal of Energy Storage. 15: 69-90. doi:10.1016/j.est.2017.10.020. ISSN 2352-152X.
- ^ a b J. Electrochem.
- ^ "High-performance flow battery could rival lithium-ions for EVs and grid storage". Gizmag. 27 Şubat 2015. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar
|ad1=eksik|soyadı1=(yardım) - ^ "New flow battery to keep big cities lit, green and safe". R&D. 25 Şubat 2015. 4 Eylül 2018 tarihinde kaynağından arşivlendi. Erişim tarihi: 28 Temmuz 2023. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar
|ad1=eksik|soyadı1=(yardım) - ^ Weng (2017). "Unlocking the capacity of iodide for high-energy-density zinc/polyiodide and lithium/polyiodide redox flow batteries". Energy & Environmental Science. 10 (3): 735-741. doi:10.1039/C6EE03554J.
- ^ M.Aziz et al.
- ^ Brushett (2012). "An All‐Organic Non‐aqueous Lithium‐Ion Redox Flow Battery". Advanced Functional Materials (İngilizce). 2 (11): 1390-1396. doi:10.1002/aenm.201200322.
- ^ Bamgbopa (2017). "The potential of non-aqueous redox flow batteries as fast-charging capable energy storage solutions: demonstration with an iron–chromium acetylacetonate chemistry". Journal of Materials Chemistry A (İngilizce). 5 (26): 13457-13468. doi:10.1039/c7ta02022h. ISSN 2050-7488.
- ^ Luo, J. (2017). "Unraveling pH Dependent Cycling Stability of Ferricyanide / Ferrocyanide in Redox Flow Batteries". Nano Energy. 2017, 42: 215-221. doi:10.1016/j.nanoen.2017.10.057.
- ^ "New flow battery projected to cost 60% less than existing standard". www.gizmag.com. 22 Aralık 2015. 24 Aralık 2015 tarihinde kaynağından arşivlendi. Erişim tarihi: 23 Aralık 2015. Yazar
|ad1=eksik|soyadı1=(yardım) - ^ Liu (1 Kasım 2015). "A Total Organic Aqueous Redox Flow Battery Employing a Low Cost and Sustainable Methyl Viologen Anolyte and 4-HO-TEMPO Catholyte". Advanced Energy Materials (İngilizce). 6 (3): 1501449. doi:10.1002/aenm.201501449. ISSN 1614-6840.
- ^ Luo, J. "Unprecedented Capacity and Stability of Ammonium Ferrocyanide Catholyte in pH Neutral Aqueous Redox Flow Batteries". Joule. 4: 149-163. 29 Kasım 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 28 Temmuz 2023.
- ^ Gong (2015). "Nonaqueous redox-flow batteries: organic solvents, supporting electrolytes, and redox pairs". Energy and Environmental Science (İngilizce). 8 (12): 3515-3530. doi:10.1039/C5EE02341F.
- ^ Xu, Y.; Wen, Y.; Cheng, J.; Yanga, Y.; Xie, Z.; Cao, G. In World Non-Grid-Connected Wind Power and Energy Conference, 2009.
- ^ Xu (2010). "A study of tiron in aqueous solutions for redox flow battery application". Electrochimica Acta. 55 (3): 715-720. doi:10.1016/j.electacta.2009.09.031. ISSN 0013-4686.
- ^ "New water-based organic battery is cheap, rechargeable and eco-friendly". Gizmag. 29 Haziran 2014. 5 Temmuz 2014 tarihinde kaynağından arşivlendi. Yazar
|ad1=eksik|soyadı1=(yardım) - ^ "A rechargeable battery to power a home from rooftop solar panels". phys.org. 25 Eylül 2015 tarihinde kaynağından arşivlendi.
- ^ Matthew Gunther,ChemistryWorld. "Flow Battery Could Smooth Irregular Wind and Solar Energy Supply". Scientific American. 29 Eylül 2015 tarihinde kaynağından arşivlendi.
- ^ Alkaline quinone flow battery Lin et al.
- ^ "Greener, safer flow battery could store renewable energy on the cheap". www.gizmag.com. 30 Eylül 2015. 2 Ekim 2015 tarihinde kaynağından arşivlendi. Erişim tarihi: 8 Aralık 2015. Yazar
|ad1=eksik|soyadı1=(yardım) - ^ a b Carretero-González (2016). "Highly water-soluble three-redox state organic dyes as bifunctional analytes". Energy & Environmental Science (İngilizce). 9 (11): 3521-3530. doi:10.1039/C6EE01883A. ISSN 1754-5692.
- ^ a b Winsberg (11 Kasım 2016). "TEMPO/Phenazine Combi-Molecule: A Redox-Active Material for Symmetric Aqueous Redox-Flow Batteries". ACS Energy Letters (İngilizce). 1 (5): 976-980. doi:10.1021/acsenergylett.6b00413. ISSN 2380-8195.
- ^ a b Potash (2016). "On the Benefits of a Symmetric Redox Flow Battery". Journal of the Electrochemical Society (İngilizce). 163 (3): A338-A344. doi:10.1149/2.0971602jes. ISSN 0013-4651.
- ^ "Symmetrical flow battery may strike right balance for grid-scale storage". New Atlas (İngilizce). 17 Mart 2022. 17 Mart 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 18 Mart 2022. Yazar
|ad1=eksik|soyadı1=(yardım) - ^ "Candle compound brings high density to grid-scale battery technology". New Atlas (İngilizce). 21 Mayıs 2021. 21 Mayıs 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 26 Mayıs 2021. Yazar
|ad1=eksik|soyadı1=(yardım) - ^ Feng (21 Mayıs 2021). "Reversible ketone hydrogenation and dehydrogenation for aqueous organic redox flow batteries". Science (İngilizce). 372 (6544): 836-840. doi:10.1126/science.abd9795. ISSN 0036-8075. PMID 34016776. 18 Temmuz 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 28 Temmuz 2023.
- ^ a b c Robb (2019). "Chelated Chromium Electrolyte Enabling High-Voltage Aqueous Flow Batteries". Joule (İngilizce). 3 (10): 2503-2512. doi:10.1016/j.joule.2019.07.002.Robb, Brian H.; Farrell, Jason M.; Marshak, Michael P. (2019).
- ^ "Energy Storage: GridStar Flow". Lockheed Martin. 22 Nisan 2018 tarihinde kaynağından arşivlendi. Erişim tarihi: 27 Temmuz 2020.
- ^ "Chemists present an innovative redox-flow battery based on organic polymers and water". phys.org. Phys.org. 21 Ekim 2015. 22 Ekim 2015 tarihinde kaynağından arşivlendi. Erişim tarihi: 6 Aralık 2015.
- ^ a b Janoschka (2015). "An aqueous, polymer-based redox-flow battery using non-corrosive, safe, and low-cost materials". Nature. 527 (7576): 78-81. doi:10.1038/nature15746. PMID 26503039.
- ^ Bamgbopa (2017). "Prospects of recently developed membraneless cell designs for redox flow batteries". Renewable and Sustainable Energy Reviews. 70: 506-518. doi:10.1016/j.rser.2016.11.234. ISSN 1364-0321.
- ^ Bamgbopa (2018). "Cyclable membraneless redox flow batteries based on immiscible liquid electrolytes: Demonstration with all-iron redox chemistry". Electrochimica Acta. 267: 41-50. doi:10.1016/j.electacta.2018.02.063. ISSN 0013-4686.
- ^ Qi (2017). "Review Article: Flow battery systems with solid electroactive materials". Journal of Vacuum Science & Technology B, Nanotechnology and Microelectronics: Materials, Processing, Measurement, and Phenomena (İngilizce). 35 (4): 040801. doi:10.1116/1.4983210. ISSN 2166-2746.
- ^ "Semi-Solid Lithium Rechargeable Flow Battery". Advanced Energy Materials. 1 (4): 511-516. May 2011. doi:10.1002/aenm.201100152. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar
|ad1=eksik|soyadı1=(yardım) - ^ Qi (15 Ağustos 2016). "A carbon-free lithium-ion solid dispersion redox couple with low viscosity for redox flow batteries". Journal of Power Sources. 323: 97-106. doi:10.1016/j.jpowsour.2016.05.033.
- ^ Qi (20 Şubat 2017). "Carbon-free Solid Dispersion LiCoO2 Redox Couple Characterization and Electrochemical Evaluation for All Solid Dispersion Redox Flow Batteries". Electrochimica Acta. 228: 91-99. doi:10.1016/j.electacta.2017.01.061.
- ^ "Go with the Flow – Cambridge Crude". Technology Review. 23 Ağustos 2011. 13 Ocak 2016 tarihinde kaynağından arşivlendi. Erişim tarihi: 28 Temmuz 2023. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar
|ad1=eksik|soyadı1=(yardım) - ^ Redox-Targeting-Based Flow Batteries for Large-Scale Energy Storage.
- ^ Redox targeting-based flow batteries.
- ^ Redox Targeting Improves Flow Batteries.
- ^ Single-Molecule Redox-Targeting Reactions for a pH-Neutral Aqueous Organic Redox Flow Battery.
- ^ Redox targeting of energy materials.
- ^ Redox Targeting of Energy Materials for Energy Storage and Conversion.
- ^ "130+ million publications organized by topic on ResearchGate". 13 Ağustos 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 21 Mayıs 2023.
- ^ Tolmachev, Yuriy, and Svetlana V. Starodubceva.
- ^ "Room-temperature flow battery uses liquid sodium-potassium alloy". 20 Temmuz 2018. 21 Ocak 2019 tarihinde kaynağından arşivlendi. Yazar
|ad1=eksik|soyadı1=(yardım) - ^ Li (11 Ekim 2017). "Air-Breathing Aqueous Sulfur Flow Battery for Ultralow-Cost Long-Duration Electrical Storage". Joule. 1 (2): 306-327. doi:10.1016/j.joule.2017.08.007.
- ^ "Advances in flow batteries promise cheap backup power". Science. 362 (6414): 508-509. 2 Kasım 2018. doi:10.1126/science.362.6414.508. PMID 30385552. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar
|ad1=eksik|soyadı1=(yardım) - ^ "A Zinc-Chloride Battery - The Missing Link to a Practical Electric Car". SAE Technical Paper Series. 1. 1 Şubat 1973. doi:10.4271/730248 – www.sae.org vasıtasıyla. Yazar
|ad1=eksik|soyadı1=(yardım)