Hidrogén-klorid
| Ehhez a szócikkhez további forrásmegjelölések, lábjegyzetek szükségesek az ellenőrizhetőség érdekében. Emiatt nem tudjuk közvetlenül ellenőrizni, hogy a szócikkben szereplő állítások helytállóak-e. Segíts a szócikk fejlesztésében további megbízható források hozzáadásával. |
A hidrogén-klorid színtelen, szúrós szagú, levegőnél nagyobb sűrűségű, mérgező gáz, képlete HCl. Vízben jól oldódik, vizes oldata a sósav, melyet először Basilius Valentinus állított elő a 15. században, egészen tiszta állapotban pedig Glauber. Előfordul a természetben némely vulkáni gázban és Dél-Amerika néhány folyójában, amelyek vulkáni vidéken folynak keresztül; a gyomornedvben is megtalálható, minthogy az emésztésnek igen fontos tényezője.
| Hidrogén-klorid | |||
| |||
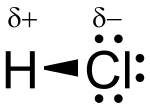
 2 dimenziós szerkezet |
 3 dimenziós szerkezet | ||
| IUPAC-név | hidrogén-klorid | ||
| Szabályos név | klorán | ||
| Más nevek | sósavgáz | ||
| Kémiai azonosítók | |||
| CAS-szám | 7647-01-0 | ||
| PubChem | 313 | ||
| ChemSpider | 307 | ||
| EINECS-szám | 231-595-7 | ||
| KEGG | D02057 | ||
| MeSH | Hydrochloric+acid | ||
| ChEBI | 17883 | ||
| RTECS szám | MW4025000 | ||
| |||
| |||
| InChIKey | VEXZGXHMUGYJMC-UHFFFAOYSA-N | ||
| Gmelin | 322 | ||
| UNII | QTT17582CB | ||
| UN-szám | 1050 | ||
| ChEMBL | 1231821 | ||
| Jmol 3D képek | Kép | ||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | HCl | ||
| Moláris tömeg | 36,46 | ||
| Megjelenés | színtelen, szúrós szagú, higroszkópos gáz | ||
| Halmazállapot | gáz | ||
| Sűrűség | 1,52 g/dm³ (20 °C) | ||
| Olvadáspont | −114,22 °C (158,8 K) | ||
| Forráspont | −85,05 °C (187,9 K) | ||
| Oldhatóság (vízben) | 82,3 g/100 ml (0 °C) 72,0 g/100 ml (20 °C) 56,1 g/100 ml (60 °C) | ||
| Oldószerei | metanol, etanol, éter | ||
| Savasság (pKa) | −7,0[1] | ||
| Lúgosság (pKb) | 21,0 | ||
| Törésmutató (nD) | 1,0004456 (gáz) 1,254 (folyadék) | ||
| Viszkozitás | 0,311 cP (−100 °C) | ||
| Gőznyomás | 4352 kPa (21,1 °C-on)[2] | ||
| Kristályszerkezet | |||
| Molekulaforma | lineáris, dipólusmolekula | ||
| Termokémia | |||
| Std. képződési entalpia ΔfH |
−92,31 kJ mol−1 | ||
| Standard moláris entrópia S |
186,902 J K−1 mol−1 | ||
| Hőkapacitás, C | 0,7981 J K−1 g−1 | ||
| Veszélyek | |||
| MSDS | JT Baker MSDS | ||
| Főbb veszélyek | |||
| NFPA 704 | |||
| R mondatok | R23, R35[3] | ||
| S mondatok | (S1/2), S9, S26, S36/37/39, S45[3] | ||
| Öngyulladási hőmérséklet | nem gyúlékony | ||
| LD50 | 238 mg/kg (patkány, szájon át) | ||
| Rokon vegyületek | |||
| Azonos kation | Hidrogén-fluorid Hidrogén-bromid Hidrogén-jodid | ||
| Azonos anion | Kloridok | ||
| Az infoboxban SI-mértékegységek szerepelnek. Ahol lehetséges, az adatok standardállapotra (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. Az ezektől való eltérést egyértelműen jelezzük. | |||
Előállítása és felhasználása
szerkesztésA hidrogén-klorid hidrogénből és klórból képződik magas hőmérsékleten (250 °C felett) vagy fény[4] hatására. Az egyesülés durranás kíséretében történik, ha az említett két gáznak egyenlő térfogatait elegyítettük egymással.
A hidrogén- és a klórgáz 1:1 térfogatarányú elegyét klórdurranógáznak nevezzük, mely még az oxigén-hidrogén durranógáznál is robbanékonyabb.
A hidrogén-klorid előállítható a kloridokból, ha azokat koncentrált kénsavval melegítjük; e célra azonban iparilag konyhasót (NaCl) használnak, amelyet kénsavval kezelnek. A reakció mellékterméke a glaubersó, melyet a gyógyászatban hashajtásra használnak.
Szerves vegyületek klórozásánál melléktermékül igen nagy mennyiségben keletkezik.[4][6]
Cseppfolyós állapotban közvetlenül felhasználható telítetlen szénhidrogének hidrohalogénezésére (pl. vinil-klorid vagy etil-klorid előállítására).[6] Felhasználják továbbá vízmentes ammónium-klorid és fém-kloridok előállítására, valamint sósavtermelésre is.[7]
Jellemzői
szerkesztésA hidrogén-klorid-gáz igen alacsony hőmérsékletre lehűtve, nagyobb nyomáson színtelen folyadékká sűríthető. A hidrogén-klorid-gáz levegőre vonatkoztatott relatív sűrűsége: ρrel = 1,278 (levegő = 1) és vízben rendkívül jól oldódik; 1 térfogat víz 0 °C-on 505 térfogat (0,825 g), 20 °C-on 440 térfogat (0,721 g) hidrogén-klorid-gázt abszorbeál; ezért hidrogén-klorid-gázzal telt palack víz alatt kinyitva egy pillanat alatt megtelik vízzel.
Az oxidáló hatású anyagok (például nátrium-hipoklorit azaz hypo, kálium-permanganát, kálium-klorát stb.) a hidrogén-kloridot elbontják és ekkor klórgáz fejlődik belőle.
Szerkezete és tulajdonságai
szerkesztésA szilárd HCl 98,4 K-en fázisátmeneten megy keresztül. Az anyag porröntgendiffrakciós vizsgálata alapján a szerkezet az átmenet során rombosból köbös rendszerűvé változik. A klóratomok mindkét szerkezetben lapközéppontos rácsot alkotnak, ám a hidrogének helyzetét nem lehet meghatározni.[8] A spektroszkópiai és dielektromos jellemzők vizsgálata, valamint a DCl (deutérium-klorid) megállapított szerkezete alapján a HCl szilárd fázisban zegzugos láncokat alkot, ugyanúgy, mint a HF (lásd a jobb oldali ábrát).[9]
| Hőmérséklet (°C) | 0 | 20 | 30 | 50 |
|---|---|---|---|---|
| Víz | 823 | 720 | 673 | 596 |
| Metanol | 513 | 470 | 430 | |
| Etanol | 454 | 410 | 381 | |
| Éter | 356 | 249 | 195 |
A gázállapotú hidrogén-klorid – oldalt bemutatott – infravörös spektruma számos éles abszorpciós vonalat tartalmaz, melyek 2886 cm−1 (~3,47 µm-es hullámhossz) körül csoportosulnak. Szobahőmérsékleten csaknem minden molekula a v = 0 rezgési alapállapotban van. Ahhoz, hogy egy HCl molekula a v = 1 állapotba gerjesztődjön, körülbelül 2880 cm−1-es infravörös gerjesztés szükséges. Ezt a Q-ágba tartozó abszorpciót szimmetria tiltott volta miatt nem figyelhetjük meg. Ehelyett két jelcsoport (P- és R-ágak) észlelhető, melyeket a molekula forgása okoz. A kvantummechanikai kiválasztási szabályok miatt csak bizonyos forgási módusok megengedettek. Ezt a J forgási kvantumszám jellemzi, J = 0, 1, 2, 3, ... . A kiválasztási szabályok szerint ΔJ értéke csak ± 1 lehet.
- E(J) = h·B·J(J+1)
B értéke sokkal kisebb, mint ν·e, ezért a molekula megforgatásához sokkal kisebb energia szükséges, az átlagos molekulák esetén ez az energia a mikrohullámú tartományba esik. A HCl molekula rezgési energiája azonban már az infravörös tartományba esik, így a molekula forgási-rezgési módusait mutató spektrum kényelmesen felvehető egy hagyományos gázcella és infravörös spektrofotométer segítségével.
A természetben előforduló klór két izotópból áll, ezek a 35Cl és 37Cl, arányuk közelítőleg 3:1. Bár a kétféle izotópot tartalmazó molekulák rugóállandói nagyon hasonlóak, a redukált tömeg különbsége miatt a forgási energiák eléggé eltérnek ahhoz, hogy az abszorpciós vonalak alaposabb tanulmányozásával ezek a dublettek megfigyelhetők lehessenek. A dublett vonalainak intenzitásaránya ugyanúgy 3:1.
Jegyzetek
szerkesztés- ↑ Perrin, D. D. Dissociation constants of inorganic acids and bases in aqueous solution. Butterworths, London, 1969.
- ↑ Hydrogen Chloride Archiválva 2014. február 22-i dátummal a Wayback Machine-ben. Gas Encyclopaedia. Air Liquide
- ↑ a b c A hidrogén-klorid vegyülethez tartozó bejegyzés az IFA GESTIS adatbázisából. (JavaScript szükséges) (angolul)
- ↑ a b Hans Breuer. Atlasz – Kémia, második, javított kiadás, Budapest: Athenaeum 2000 Kiadó, 191. o. (2000). ISBN 963 926124 6
- ↑ szerk.: Náray-Szabó Gábor: Kémia. Budapest: Akadémiai Kiadó, 355. o. (2006). ISBN 963 05 8240 6
- ↑ a b Römpp vegyészeti lexikon: Második kötet F–K. Budapest: Műszaki Könyvkiadó, 457. o. (1982). ISBN 963 10 3813 0
- ↑ Greenwood, N.N.. Az elemek kémiája, 1., Budapest: Nemzeti Tankönyvkiadó, 1102. o. (1999). ISBN 963-18-9144-5
- ↑ Natta, G. (1933). „Struttura e polimorfismo degli acidi alogenidrici” (olasz nyelven). Gazzetta Chimica Italiana 63, 425–439. o.
- ↑ Sándor, E. (1967). „Crystal Structure of Solid Hydrogen Chloride and Deuterium Chloride”. Nature 213 (5072), 171–172. o. DOI:10.1038/213171a0.
- ↑ Hydrochloric Acid - Compound Summary. Pubchem
